您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-22 10:22
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.恒瑞造影剂钆布醇获FDA批准上市。恒瑞医药仿制药钆布醇注射液获FDA批准上市。钆布醇是一款核磁共振造影剂,原研产品由拜耳开发,商品名为Gadovist,1999年在瑞士获批上市,并于2009年9月在中国获批,2011年3月在美国获批。值得一提的是,恒瑞的钆布醇注射液也是该品种的国内首仿药,是国内首家通过仿制药一致性评价的产品。
2.信立泰自免病1类新药报IND。信立泰自主研发的1类化药SAL0119片的临床试验申请获国家药监局受理。SAL0119是一款小分子免疫抑制剂,具有不同于JAK类的作用机制和广谱的细胞因子抑制作用,拟开发用于治疗包括活动性强直性脊柱炎(AS)及中重度活动性类风湿关节炎(RA)等自身免疫疾病。SAL0119已在临床前研究中显示出良好的有效性和安全性,有望为AS、RA患者提供新的用药选择。
3.迈威FIC单抗在美获批罕见血癌临床。迈威生物自主研发的9MW3011注射液获FDA临床试验许可,拟开展用于真性红细胞增多症患者的临床试验。9MW3011是一款创新靶点单抗药物,可通过特异性结合,上调肝细胞表达铁调素的水平,抑制铁的吸收和释放,降低血清铁水平,从而调节体内的铁稳态。在中国,该新药拟临床用于β-地中海贫血和真性红细胞增多症的IND申请已获得CDE受理。
4.绿叶精分症新药关键临床积极。绿叶制药棕榈酸帕利哌酮缓释混悬注射液(LY03010)在美国开展的用于治疗精神分裂症和分裂情感性障碍的关键临床(Invega Sustenna)达到预期终点。试验结果显示,与对照药的初始给药方案相比,LY03010在多次给药达到稳态的生物等效性。临床中,没有出现新的治疗相关不良事件。绿叶制药计划通过505(b)(2)的途径向FDA提交LY03010的上市申请。
5.三迭纪又一3D打印改良新药获批临床。南京三迭纪医药自主研发的第三款3D打印药物T21获FDA临床试验许可。T21在FDA通过505(b)(2)路径进行注册申报,原研是一款治疗溃疡性结肠炎的药物。三迭纪通过精巧的制剂三维结构设计,实现了T21结肠靶向的递送。与原研药相比,T21较低的药物剂量和精准的结肠释药,降低全身血药浓度暴露量,减少药物的副作用。
国际药讯
1.首个AADCD基因疗法获批上市。PTC Therapeutics公司AAV基因疗法Upstaza™获英国药品和保健产品管理局(MHRA)批准上市,用于治疗18个月及以上芳香族L-氨基酸脱羧酶(ADCC)缺乏症患者。Upstaza是首款基因疗法用于直接注入大脑,通过AAV2载体将功能正常的DDC基因递送到大脑的壳核中,提高AADC酶的水平并恢复多巴胺的生产。在临床研究中,Upstaza可显著改善患者的运动功能并维持长达10年。
2.法布里病新药在美报BLA。Protalix公司与Chiesi Global Rare Diseases联合开发的创新聚乙二醇化α-半乳糖苷酶A疗法pegunigalsidase alfa(PRX–102)已重新向FDA提生物制品许可申请(BLA),用于治疗法布里病(Fabry disease)成人患者。在关键性Ⅲ期临床中,与酶替代疗法活性对照组相比,PRX–102治疗组患者24个月时肾功能改善达到非劣效性标准。目前,欧洲药品管理局(EMA)也正在审查pegunigalsidase alfa的营销授权申请(MAA)。
3.双环肽眼科新药向FDA提交新数据。FDA受理Apellis公司靶向补体C3的聚乙二醇化双环肽疗法pegcetacoplan用于治疗年龄相关性黄斑变性(AMD)继发地图样萎缩(GA)上市申请(NDA)的主动重大修订。Apellis公司在原有18个月和1年的结果基础上,再提交III期DERBY和OAKS研究的24个月疗效数据;24个月的数据显示,每隔一个月和每月一次的pegcetacoplan治疗的效果不断增加且一致,两项研究都显示出良好的安全性。更新的PDUFA日期是2023年2月26日。
4.创新PI3Kδ抑制剂淋巴瘤Ⅱ期临床积极。Kyowa Kirin与MEI Pharma开发的PI3Kδ抑制剂zandelisib在治疗特定惰性B细胞非霍奇金淋巴瘤(iB-NHL)的Ⅱ期临床(MIRAGE)结果积极。数据显示,zandelisib单药在至少经两线系统治疗的患者中达到75.4%的客观缓解率(95% CI:62.7-85.5)和24.6%的完全缓解率(95% CI:14.5-37.3)。目前最终缓解持续时间(DOR)的数据尚未成熟。在中位随访期9.5个月(95% CI:8.0-11.1)时,有14.8%患者因治疗伴发不良反应(TEAE)停止治疗。
5.WT1免疫疗法联合K药治疗卵巢癌临床积极。SELLAS生命科学集团开发的WT1靶向免疫疗法galinpepimut-S(GPS)联合PD-1疗法Keytruda治疗WT1阳性、铂耐药的复发性晚期卵巢癌的Ⅰ/Ⅱ期临床结果积极。与PD-1疗法相比,这一组合显著改善患者的无进展生存期(PFS,12周vs8周)和总生存期(中位OS:18.4个月vs13.8个月)。联合治疗的安全性良好,与单独使用Keytruda治疗时的安全性相似。
6.首款TIL疗法推迟上市计划。Iovance公司宣布将于2023年Q1完成向FDA滚动提交肿瘤浸润淋巴细胞(TIL)疗法lifileucel的生物制剂许可证申请(BLA),用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。今年8月,基于II期C-144-01研究的积极结果,Iovance向FDA滚动提交lifileucel的BLA;原定的提交计划为今年年底。日前,FDA就lifileucel的BLA提出了“补充检测验证信息和可比性数据”的反馈意见。lifileucel是美国国立卫生研究院(NIH)开发的一种自体细胞疗法。
医药热点
1.全国首个综合类国家医学中心落地。11月18日,全国首个综合类国家医学中心建设项目在复旦大学附属中山医院启动。中山医院国家医学中心建设项目将新建上海国际医学科创中心(8.96万m²)和青浦新城院区一期工程(17.13万m²),依托徐汇总部院区和佘山院区部署落实各功能中心任务。上海国际医学科创中心位于徐汇区斜土路,设置有500张研究型床位,建设有医工交叉技术创新中心、临床诊疗前沿技术创新中心、临床试验服务平台、人才交流和成果转化平台等功能平台,拟加速推动医学研究成果转化。
2.北京长庚医院成立钇90介入放疗中心。11月20日,清华大学附属北京清华长庚医院钇[90Y]精准肝脏肿瘤介入放疗中心正式成立,标志着医院步入高水平特色专病中心建设的新征程。2021年9月,北京清华长庚医院院长董家鸿院士牵头组建跨领域、多机构、多学科专家团队,成功引入并在海南落地实施国内首例特许准入钇[90Y]树脂微球临床治疗肝癌项目,开启了中国肝脏肿瘤治疗的精准介入治疗时代。
3.联防联控机制连发四个重要文件。国务院联防联控机制综合组制定并印发《新冠肺炎疫情防控核酸检测实施办法》《新冠肺炎疫情风险区划定及管控方案》《新冠肺炎疫情居家隔离医学观察指南》《新冠肺炎疫情居家健康监测指南》,要求各地各部门认真组织实施。其中《新冠肺炎疫情防控核酸检测实施办法》明确,没有发生疫情的地区,严格按照第九版防控方案确定的范围对风险岗位、重点人员开展核酸检测,不得扩大核酸检测范围,一般不按行政区域开展全员核酸检测。
评审动态
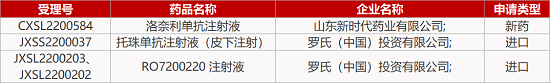
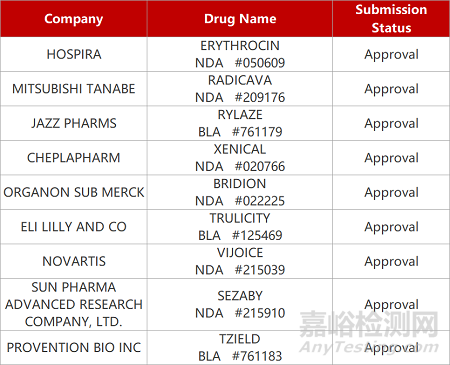

来源:药研发


