今日头条
舒泰神FcRn单抗获批自免病临床。舒泰神1类生物药STSA-1301皮下注射液获国家药监局临床默示许可,拟开发用于治疗原发免疫性血小板减少症 (ITP) 。STSA-1301是一款重组抗人FcRn高亲和力人源化IgG4单克隆抗体。通过特异性结合FcRn,使其丧失和IgG结合的能力,加速IgG的降解,同时不影响IgM、IgA等其他类型抗体,从而有望达到治疗ITP等致病性IgG自身抗体介导的自身免疫性疾病的目的。
国内药讯
1.基石PD-L1单抗获附条件批准新适应症。基石药业PD-L1抗体舒格利单抗(择捷美®)获国家药监局附条件批准新适应症,单药用于治疗复发或难治性结外NK/T细胞淋巴瘤(R/R ENKTL)成人患者。在GEMSTONE-201研究中,舒格利单抗经IRRC评估的ORR达到46.2%,其中完全缓解率达到37.2%。舒格利单抗是全球首个获批用于R/R ENKTL患者的肿瘤免疫治疗药物,将改变现阶段R/R ENKTL患者的治疗格局。
2.礼来Aβ单抗中国报产。礼来Aβ单抗donanemab的上市申请获国家药监局受理。Donanemab旨在通过与阿尔茨海默病(AD)患者大脑中沉积中的β淀粉样蛋白结合,以促进大脑中淀粉样蛋白斑块的清除。在Ⅲ期TRAILBLAZER-ALZ 2研究中,donanemab治疗组患者的iADRS评分和CDR-SB评分的下降速度分别减缓35%和36%,疾病进展速度延缓40%。今年年初,CDE已将Donanemab纳入突破性治疗品种,用于治疗早期症状性AD。
3.康宁杰瑞PD-L1获批子宫内膜癌Ⅲ期临床。康宁杰瑞皮下注射PD-L1抗体恩沃利单抗(恩维达®)获FDA批准开展Ⅲ期临床(KN035-US-004),评估恩沃利单抗联合仑伐替尼对比卡铂-紫杉醇化疗用于一线治疗错配修复完整(pMMR)晚期或复发性子宫内膜癌患者的有效性与安全性。在美国,该新药还曾获得FDA授予的用于治疗晚期胆道癌及治疗软组织肉瘤的2项孤儿药资格。
4.艾力斯EGFR-TKI获肺癌突破性疗法认定。艾力斯医药自主研发第三代EGFR-TKI创新药伏美替尼片获FDA突破性疗法认定,用于一线治疗EGFR 20外显子插入突变的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者。公布于WCLC2023年会上的Ⅰb期临床(FAVOUR)结果显示,经IRC评估,初治240mg组、经治240mg组、经治160mg组的确证客观缓解率(ORR)分别为78.6%、46.2%、38.5%,中位缓解持续时间(DoR)分别为15.2个月、13.1个月、9.7个月。
5.恒瑞源正细胞疗法获批Ⅱ期临床。恒瑞源正1类生物制品多抗原自体免疫细胞注射液(MASCT-I)获国家药监局批准开展Ⅱ期临床,评价MASCT-I联合多柔比星和异环磷酰胺一线治疗晚期软组织肉瘤患者的有效性和安全性。MASCT-I的活性成份包括负载多种肿瘤相关抗原的DC细胞以及DC细胞活化扩增的自体效应T淋巴细胞。目前,MASCT-I也正在Ⅱ期临床中评估用于治疗尿路上皮癌的潜力。
国际药讯
1.诺华ETAR抑制剂IgA肾病III期临床积极。诺华高选择性内皮素A(ETA)受体抑制剂Atrasentan治疗IgA肾病的III期ALIGN研究达到主要终点。期中结果显示,与安慰剂相比,Atrasentan治疗组患者36周时蛋白与肌酐浓度比(UPCR)较基线的变化具有统计学意义的改善,患者的蛋白尿显著减少;其安全性与既往研究一致。诺华计划基于中期数据向FDA寻求加速批准上市。
2.葛兰素史克PD-1抗体子宫内膜癌Ⅲ期临床成功。葛兰素史克PD-1抑制剂Jemperli(dostarlimab)联合标准化疗(卡铂和紫杉醇)、之后Jemperli单药的一线方案,在治疗原发性晚期或复发性子宫内膜癌的Ⅲ期临床RUBY达到总生存期(OS)的主要终点。在两个预定的亚群中(dMMR/MSI-H和MMRp/MSS),Jemperli组合均显著提高患者的OS。此前,该组合已达到无进展生存期(PFS)的主要终点,在dMMR/MSI-H亚群和总体患者群中分别降低72%和36%的疾病进展或死亡风险。此外,药物的安全性与已知研究一致。
3.大冢多动症新药两项Ⅲ期临床积极。大冢制药潜在“first-in-class”疗法centanafadine治疗注意力缺陷/多动障碍的两项Ⅲ期临床均达到主要终点。与安慰剂相比,centanafadine治疗均能显著改善青少年(13-17岁)和儿童(6-12岁)患者的ADHD-RS-5量表评分,且药物安全性良好。Centanafadine是Neurovance公司(已被大冢制药收购)开发的一种甲肾上腺素、多巴胺和5-羟色胺再摄取抑制剂(NDSRI)。
4.CSF1R激酶抑制剂TGCT关键Ⅲ期临床成功。Deciphera公司口服CSF1R激酶抑制剂vimseltinib治疗腱鞘巨细胞瘤(TGCT)患者的Ⅲ期(MOTION)试验达到主要和所有关键次要终点。在意向治疗(ITT)人群中,vimseltinib治疗组和安慰剂组第25周时的客观缓解率分别为40%(95% CI:29%-51%)和0%(95% CI:0%-9%),组间差异为40%(95% CI:29%-51%,p<0.0001);药物的安全性与之前研究一致。该公司计划明年向FDA和欧盟递交上市申请。
5.补体C3疗法眼科Ⅲ期临床见刊《柳叶刀》。Apellis公司在《柳叶刀》上发表其靶向C3补体蛋白的聚乙二醇化(PEGylated)双环肽疗法Syfovre(pegcetacoplan)治疗继发于年龄相关性黄斑变性(AMD)的地图样萎缩(GA)的Ⅲ期(OAKS和DERBY)研究积极结果。数据显示,每隔一个月和每月一次的Syfovre治疗均能显著减少GA病变的生长。今年2月,FDA已批准Syfovre用于治疗由AMD引起的地图样萎缩(GA)。
6.DMD基因疗法Ⅲ期验证临床失败。Sarepta公司治疗杜氏肌营养不良(DMD)的基因疗法Elevidys在Ⅲ期验证性临床EMBARK中未达到主要终点。与安慰剂组相比,Elevidys治疗组患者的与运动功能相关的NSAA评分显示改善趋势,但不具统计学意义;而次要终点TTR和10MWR指标的统计则显著改善。今年6月,基于Elevidys在临床试验中显著提高患者肌肉中微抗肌萎缩蛋白的表达水平的替代终点结果,FDA已加速批准Elevidys上市。
医药热点
1.辉瑞将裁员近800人。10月30日,根据新泽西州发布的《工人调整和再培训通知》(WARN),辉瑞将在新泽西州格拉德斯通裁员791人。这轮裁员计划预计将于2024年2月生效。10月16日,辉瑞因新冠业务下滑而下调了2023全年指引,将今年收入预期下调至580亿至610亿美元,比之前发布的指导性目标减少90亿美元。
2.浙江中医药大学富春校区开工。近日,浙江中医药大学富春校区建设工程开工。这是浙江省重点建设项目、扩大有效投资“千项万亿”工程重大项目和公共服务“七优享”(学有优教)工程重大项目。项目总用地面积679.83亩,总建筑面积325000平方米。项目建成后,浙江中医药大学总部将搬迁至富春校区,进一步拓展办学空间、提升办学条件,助力建设一流中医药大学。
3.复旦大学团队发布医生科普评价报告。据复旦大学发展研究院10月27日消息,复旦大学新闻学院孙少晶教授团队和复旦大学发展研究院王帆研究员团队历时半年多,通过对抖音、微博、微信三大社交媒体平台健康科普内容的抽样分析,完成《数字时代中国医生健康科普评价报告》。报告显示,在三个平台中,关于慢性疾病与生活方式的健康科普内容比较丰富,而心理健康等隐性健康话题的可见性与关注度明显不足。在阅读量较高的内容中,日常保健与疾病分析占比较高,癌症、中医药知识内容占较大比例,而心理疾病、疫苗等主题的内容相对较少。
评审动态
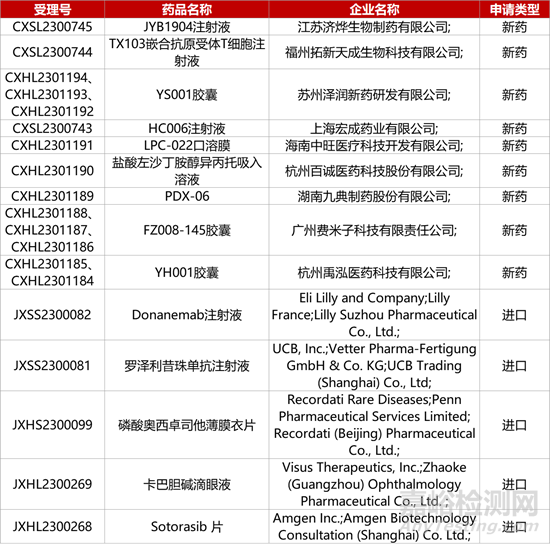
1. CDE新药受理情况(10月31日)
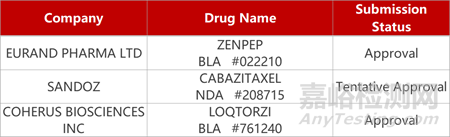
2. FDA新药获批情况(北美10月27日)