您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-02 19:25
2020年版《中华人民共和国药典》中将膜剂定义为原料药与适宜的成膜材料经加工制成的膜状制剂,供口服和黏膜用。口腔膜剂根据使用和吸收位置也可分为口溶膜(oral film)、口颊膜(buccal film)和舌下膜(sublingual film)[1]。目前国内外对口溶膜的名称暂不统一,国外常见的包括oral film 、oral thinfilm(OTF)、orodispersible films(ODF)等;国内已批准上市的口溶膜英文名通常为oral solu-ble film。近年来口腔膜剂的研发生产引起广泛关注,国内外也有多种口腔膜剂上市。
目前国家出台一系列政策扶持口溶膜的研究开发,部分口溶膜属于改良型新药。2016年国家食品药品监督管理总局发布了《关于发布化学药品注册分类改革工作方案的公告》(2016年第51号),首次提出改良型新药的概念 。2021年改良型新药的发展已列入国家的战略规划中,《“十四五”国家医药工业发展规划》中明确化学药要发展有明确临床价值的改良型新药。重点开发具有高选择性、长效缓控释等特点的复杂制剂技术,经皮、植入、吸入、口溶膜给药系统。
精神障碍类疾病常见的有抑郁症、精神分裂症、焦虑症等,此类疾病临床治疗包括对急症状态的快速控制和疗效稳定状态的长期维持等,某些精神障碍急症状态需要快速控制,但这类患者通常依从性较差,不愿服药、即使勉强服药后患者经常发生吐药或藏药等行为,从而影响治疗效果。精神障碍类治疗药物口溶膜作为新型速效制剂具有吸收快速、起效快的优点,可提高患者依从性,避免患者急症状态下的危险行为[2-4]。目前国内上市的口溶膜在精神障碍领域较为集中,笔者结合国内外上市药物的相关专利和文献及审评报告,对近年来上市且广泛应用的精神障碍类治疗药物口溶膜剂国内外上市情况、药学研究关注点进行分析 ,以期为该类制剂开发提供一定的参考借鉴。
精神障碍类治疗药物口溶膜国内外上市和申报情况
1.1 美国、欧洲和日本
目前国外上市多款口腔膜剂,适应证集中在精神、神经、镇痛、男性勃起功能障碍等。FDA批准的口腔膜剂涉及适应证较多,例如镇痛类的枸橼酸芬太尼口腔膜(film/buccal)、盐 酸丁丙诺啡口腔膜(film/buccal),抗肿瘤类的昂丹司琼口服膜(film/oral),精神障碍类盐酸丁丙诺啡/盐酸纳洛酮舌下膜(film/sub-lingual)等;欧盟批准上市多为口腔崩解膜,活性成分包括昂丹司琼、利培酮、奥氮平、盐酸多奈哌齐、枸橼酸西地那非、佐米曲坦、苯甲酸利扎曲坦等,其中德国的口腔膜剂发展迅猛,批准的膜剂在精神神经领域较为集中,例如利培酮口腔膜剂(orodispersible film)、盐酸多奈哌齐口腔膜剂(orodispersible film)等[1-2,5]。笔者汇总了国外获批上市的部分精神障碍类口腔膜剂,其中盐酸多奈哌齐口溶膜已在日本和德国批准上市,用于阿尔茨海默型痴呆症状的治疗,见表1。目前日本上市的盐酸多奈哌齐有3个规格(3、5和10mg),主要辅料包括三氯蔗糖、羟丙纤维素、羟丙甲纤维素、聚乙二醇 400、L-薄荷醇等[6],其中3mg和5mg规格的长短边、厚度基本相同(长边20mm、短边14mm、厚度70-90μm),而10mg规格的膜剂略厚(90-110μm)。
1.2 中国
目前精神障碍类治疗药物口溶膜布局企业相对集中,活性成分较为多样。截至 2022年10月,国家药品监督管理局(National Medical Products Administration,NMPA)官方网站中可以查询到的已批准上市的口溶膜包括奥氮平口溶膜、孟鲁司特钠口溶膜、他达拉非口溶膜、昂丹司琼口溶膜、盐酸美金刚口溶膜和阿立哌唑口溶膜。已向药品审评中心提交的注册申请精神障碍类治疗药物口溶膜见表2。

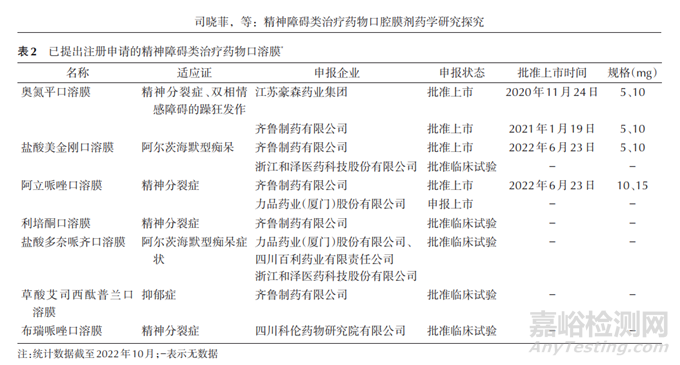
2020年11月,国家药品监督管理局批准了中国首个用于精神障碍治疗的改良型新药-奥氮平口溶膜,用于治疗精神分裂症和双相情感障碍躁狂发作。药品审评中心官方网站公布的审评报告和说明书显示,其化学药品注册分类按2. 2类申报。审评报告中指出:精神障碍患者普遍存在依从性差的问题,由于不配合口服用药,导致患者难以稳定获得症状控制所需的药量,影响临床治疗效果。其临床优势主要体现在新剂型对于解决已有剂型无法满足的临床需求方面的价值。此口溶膜剂相比于已上市的口服制剂,利于精神障碍患者藏药行为的控制,对于提高患者依从性及间接改善治疗效果有益[7-8]。2022年阿立哌唑口溶膜上市,公开的审评报告显示其在口服制剂的基础上改良,相比于现口服剂型,具有更好的防藏药特性,对于稳定患者病情有重要价值。
在注册申报时可以关注国内外产品上市情况,关注申报路径,是否可以按照注册分类 2. 2申报新药,如果按照2. 2类申报需要提供充分的立题依据,含有活性成分的新剂型需要具有明显的临床优势。
精神障碍类治疗药物口溶膜药学研究相关关注点
2.1 原料药理化性质对制剂质量的影响
原料药的基本性质,如溶解性、晶型、粒度和生物药剂学分类系统(bio-pharmaceutics classification system,BCS)等可能对制剂质量有影响。BCS分类是一种基于药物活性成分水溶性和肠道渗透性将药品分类的科学方法,可以根据其溶解性和渗透性将药物活性成分分为4类。BCS分类文献查询方式包括查询相应品种的FDA审评报告、FDA研究归纳的报告、美国国家儿童健康和人类发展研究所(National Institute of Child Health and Human Development,NICHD)和基于药物体内处置的生物药剂学分类系统(biophar⁃maceutics drug disposition classification system,BDDCS)等。精神障碍类治疗药物常见原料药的晶型及生物药剂学分类见表3。例如奥氮平、阿立哌唑的生物药剂学分类系统属于BCSⅡ类或者BCS Ⅳ类,且溶解度具有pH依赖性,原料药在胶液中可能为混悬状态。可以考察低溶解性的原料的粒径对溶出的影响,结合粒径对药品质量影响的研究,酌情在原料药内控标准中订入粒度控制项目。奥氮平和阿立哌唑均有多晶型情况,在制剂的制备过程中及稳定性考察期间是否存在晶型转化也应予以关注。一些原料药例如利培酮、阿立哌唑味苦,可以选择加入矫味剂进行掩味以改善口感。
2.2 制剂开发中的一些关注点
2.2.1 处方工艺
处方工艺方面,口腔膜剂通常由主药、成膜材料、增塑剂、矫味剂、着色剂等组成,也有加入缓冲剂、表面活性剂等。目前成膜材料一般可以分为天然聚合物和合成聚

合物。一些有良好成膜特性和生物相容性的天然聚合物,如透明质酸、麦芽糖糊精、低聚糖等被广泛研究。一些水溶性的半合成或合成聚合物在工业生产中较多使用,其生物相容性良好且质量稳定可控,如羟丙纤维素、羟丙甲纤维素、聚氧乙烯、聚维酮等[2]。增塑剂常见的有甘油、聚乙二醇400等 ,能够一定程度上改善膜的机械性能以便于分割和保存等。矫味剂可以掩蔽药物的苦味,一定程度上增加患者依从性。
膜剂生产工艺包括多种,如溶剂涂布法(流延法)、热熔挤出法、静电纺丝法(electrospinning,ES)、3D 打印(three-dimensional printing)等[2,9]。静电纺丝技术可以使高分子聚合物溶液被雾化成微小射流,溶剂蒸发后形成电纺纳米纤维,可以实现难溶性药物的快速释放,近年来开始用于制备膜剂、经皮制剂等新型药物递送系统[10]。目前工业界应用较多的为溶剂涂布法,将原料、成膜材料等辅料溶解或者混悬于适宜溶剂中形成胶液,去除气泡后涂布,水分挥发后形成薄膜。即通常的工序包括药液配制、脱泡、涂布干燥、裁剪包装等。目前商业化的涂膜设备已在国内外销售,常见的包括德国HARRO HOEFLIGER、德国OPTIMAGS等[5],注册申报中如若能够结合生产设备示意图阐述各工序(例如涂布干燥工序)工作原理及操作过程,更利于将工艺描述表述清楚易懂。以涂布干燥工序为例,涂布速度、干燥温度和干燥时间等工艺参数可以着重控制[9,11],使厚度(重量)、水分、含量均匀度等指标符合要求。由于膜剂较薄且易吸湿,在裁剪包装时需根据含药量精密裁剪合适的尺寸并控制裁片的重量,可以采用聚酯/铝/聚乙烯复合膜或纸/铝/聚乙烯复合膜等材料包装,从而确保密封性和机械性能良好。
口溶膜的生产工艺开发时由于各阶段批量不同,其采用的设备可能不同,小试、中试和商业规模放大生产的合理衔接至关重要,生产工艺中可以进一步明确关键工艺步骤和关键工艺参数、中间体控制和过程控制等。工艺描述如果足够详尽更利于研究和评价,比如配液工序可以关注药液配制顺序、搅拌速度、搅拌时间、贮存时限等。配液环节由于较高速的搅拌容易起泡,一般通过一定的方式进行消泡,可以在中间体控制或者过程控制中进行胶液中气泡残留控制,以保持涂布过程中胶液的黏度和含量均一性等指标无明显变化等。
2.2.2 质量控制
质量控制方面,需要结合口腔膜剂的制剂特点和自身产品特性进行研究确定。机械性能指标(例如耐折度、断裂强度、抗拉强度等)和生物学特性指标(例如崩解时限/溶化时限、溶出度、刺激性、黏附特性)可以特别的关注[11]。有些指标可能未列入注册标准,而列入了放行标准中进行控制。
2010年FDA批准昂丹司琼口溶膜(ZUPLENZ®)上市,其FDA药学审评报告显示质量标准包括性状、鉴别、含量、有关物质、溶出度、含量均匀度和微生物限度等。与大多数普通片剂相比,ZUPLENZ®溶出相对较快,在舌上4-21s内全部溶解。
口溶膜可以无需用液体冲服,能够快速溶化分散,溶出度和溶化时限(崩解时限)控制是口腔膜剂的关键质量指标。进行溶出度控制时应关注溶出装置选择、溶出限度拟定等方面。体外考察参比制剂与自制样品溶出相似情况,一定程度上降低体内生物不等效风险。溶出度研究时通常会结合药物性质和自身产品设计并参考 FDA 溶出度数据库等选择合适的溶出装置和溶出方法(溶出介质、转速、取样点等)。目前暂无统一公认的口溶膜溶出方法,笔者统计了FDA及日本上市的部分口腔膜剂的溶出度试验方法(表4),目前常见的包括桨法、篮法、桨碟法和流通池法等。由于口溶膜较容易漂浮,有时也会增加沉降篮装置,例如日本上市的昂丹司琼口溶膜(OD Film)使用了桨法加沉降篮装置[12-13];而使用沉降篮时样品可能发生折叠或弯曲,美国上市的昂丹司琼口溶膜(ZU⁃PLENZ®)使用了桨碟法(配不锈钢网碟)。溶化时限是此类制剂特别关注的指标,其测定方法可以模拟临床实际使用时的情形拟定,并提供科学的限度[5],不同方法间的对比研究有时可以提供更充足的依据。
日本上市的多奈哌齐口溶膜的溶出度实验方法采用了桨法装置,溶出介质体积为900mL。自制品在4种介质中(pH=1. 2、pH=4. 0、pH=6. 8 和水)中采用转速50r/min进行与参比制剂的体外溶出实验对比;并进一步在特定介质pH=6. 8中采用转速100r/min进行对比。实验结果显示,3mg规格在介质pH=4. 0和水中与参比制剂的溶出行为不相似,5mg 规格和10mg规格在介质水中与参比制剂的溶出行为不相似,其他介质中溶出行为均相似。由于药物在体内行为复杂且体外溶出方法存在局限性,体外溶出可能仅在一定程度上预测体内行为。临床试验中采用与水同服、不与水同服的空腹生物等效性试验,两者均显示膜剂与片剂生物等效,针对此品种水介质可能并不能良好的预测体内结果[6,14]。

综上所述,国内部分企业通过改良型新药途径申报口溶膜,借鉴已知主成分的研究数据,缩短临床研发周期,一定程度上符合对个体化用药等的趋势要求[3] 。口腔膜剂开发时可在充分调研国内外相关文献资料的基础上,结合制剂特点确定合理的处方工艺,建立良好的质量控制策略。
文章作者 | 司晓菲,姜典卓(国家药品监督管理局药品审评中心)
文章来源 | 临床药物治疗杂志 2023年5月 第21卷5期 1-6页

来源:Internet


