您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-25 09:24
摘要:口颊膜系指粘贴于口腔,经黏膜吸收后起全身作用的膜剂。口颊膜作为口腔黏膜给药的代表性剂型之一,具有起效快、避免药物胃肠道降解和肝脏首过效应、提高患者依从性等优势。结合近年来国内外口颊膜药物的开发和上市情况,对口颊膜处方工艺、质量研究和控制等方面进行了探讨。希望能够助力现阶段对此类产品的开发和评价,助推有临床价值的高质量口颊膜产品获批上市。
膜剂根据给药部位不同,可分为口用膜、眼用膜、阴道膜等。其中口用膜可分为口溶膜、口颊膜、舌下膜和口腔贴膜。口颊膜系指粘贴于口腔,经黏膜吸收后起全身作用的膜剂[1] 。口颊膜是口腔黏膜给药系统的代表性剂型之一,目前全球已批准上市数个口颊膜产品,国内也有数个口颊膜产品开发和申报。本文对口颊膜类药物的基本情况进行介绍,结合审评工作,对口颊膜处方工艺开发、质量控制等方面进行探讨,希望为此类产品的开发和评价提供借鉴。
1、基本情况
1.1 定义、特点和分类
2023年3月国家药典委员会对«中国药典»丸剂和膜剂通则修订草案公开征求意见[1] ,进一步将膜剂进行分类,膜剂根据给药部位不同,可分为口用膜、眼用膜、阴道膜等。其中口用膜可分为口溶膜、口颊膜、舌下膜和口腔贴膜。其中指出口颊膜系指粘贴于口腔,经黏膜吸收后起全身作用的膜剂;口颊膜应具有一定的黏附性;应进行溶出度或释放度检查。«欧洲药典»黏膜黏附制剂收载了口颊膜,其通常含有亲水聚合物,与唾液沾湿后会产生粘在口腔黏膜上的水凝胶;口颊膜可溶解,由单层或多层材料组成。«美国药典»指出口腔膜是将药物递送至口腔或将药物递送至胃肠道以供吸收。其中口颊膜可促进近端黏膜的吸收,避免胃肠道代谢或降解,并快速起效。
与传统口服给药剂型相比,口颊膜具有自身的特点。其优点包括药物起效较快;便于携带、易于使用、剂量准确;通常可避免与胃肠道等可能引起药物降解的酸性环境接触,避免肝脏的首过效应;不需要吞咽或咀嚼、对有吞咽困难的儿童和老年人有良好的患者依从性[2] 。其局限性包括唾液的分泌会影响药物的吸收,有部分药物可能会被吞咽;服药时通常限制饮食饮水(与低pH 液体同服可能会导致最大血药浓度和生物利用度下降[3] );活性成分本身的味道、刺激性可能会对口感产生的影响;药物的分子量、解离度、脂溶性和水溶性等理化性质会影响药物穿透口腔黏膜的难易程度;载药量(一般小于20mg[4] )有一定限制等。
口颊膜按照释放机理,通常分为3 类[5] ,具体见图1。Ⅰ型:单层多向释药,吞咽时会造成部分药物进入胃肠道。此类口颊膜可能有胃肠道和黏膜两种吸收途径,开发此类产品时建议根据药物生物学特性谨慎考虑。Ⅱ型:双层结构,药物位于黏附层中,在黏附层的顶部叠加不透水的背衬层,防止药物从顶表面流失到口腔中。Ⅲ型:双层单向释药,药物仅从靠近颊黏膜的一侧释放,除了与口腔黏膜接触的一面外,其他每一面均被覆盖,药物损失最小化。
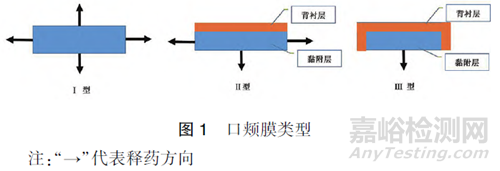
1.2 国内外开发和上市情况
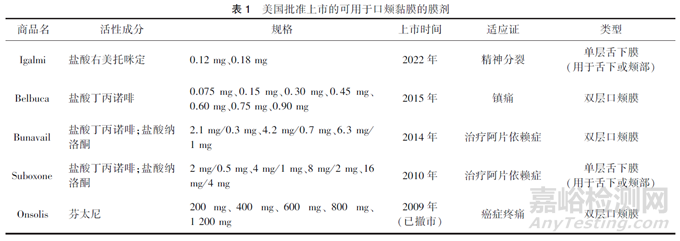
美国批准上市5 款可用于口颊黏膜的膜剂[6] ,具体见表1。其中3 个为口颊膜,且均为Ⅱ型双层口颊膜。双层口颊膜包含背衬层和黏附层,药物位于黏附层中,通过口颊的黏膜进行吸收,背衬层防止黏附层的药物在唾液中溶解。国内目前有盐酸多塞平口颊膜和盐酸帕洛诺司琼口颊膜,按2.2 类批准临床试验,尚无口颊膜类产品上市。
2、药学开发与评价关注点
2.1 处方开发
典型的口颊膜处方通常包括药物活性成分、成膜材料、增塑剂、渗透促进剂、矫味剂等。不同于传统口溶膜,口颊膜多设计为双层膜,其处方由含药层和背衬层组成。含药层应具有黏膜黏附性,延长药物在口腔黏膜的停留时间,增加药物的黏膜吸收;背衬层起阻隔和屏蔽的作用,减少由于唾液冲洗和吞咽引起的药物损失,以实现药物向口腔黏膜的单向释放。

表2汇总了FDA批准上市的Onsolis、Belbuca、Bunavail 3个产品处方信息。通过以上已上市产品处方的梳理,可了解口颊膜产品处方的常规组成,对研发和评价具有一定参考价值。Belbuca FDA Chemistry Reviews[7]显示,FDA批准的Onsolis、Belbuca、Bunavail 3个产品,均采用相同的生物可黏膜(BEMA)技术平台制备,产品由柔性水溶性聚合物膜组成,该膜黏附在湿润的口腔黏膜上并溶解,黏膜上无残留。
应结合目标产品的质量概况(QTPP)的分析,选择适宜的候选药物,并对原料药关键理化特性及生物学特性进行研究。通常活性成分应具有合适的渗透性、可递送性和可吸收性,关注相关的理化性质,如分子量、pKa、溶解性等;此外还应关注口味、黏膜刺激性、粒度及粒度分布、晶型及晶型稳定性、化学稳定性等影响产品关键质量属性的指标。
处方开发可参考ICH Q8[11] 指导原则,以制剂关键质量属性为指标,科学设计实验,对处方辅料种类及其用量进行筛选和优化。处方中所选择的辅料应无毒、无刺激性,保证产品可迅速黏附在颊黏膜处,并保持较长时间释药[5] 。口颊膜处方研究中需重点关注成膜材料、渗料透促进剂的选择和用量。成膜材料是处方中最重要的成分之一,作为药物载体可在湿润环境下提供黏附性能,口颊膜中常用的成膜材料包括胶类(如果胶)、纤维素类(如羧甲基纤维素钠、羟丙基纤维素)、聚丙烯酸聚合物类(聚丙烯酸、聚卡波菲)等[5] 。膜渗透是许多药物在口腔黏附给药系统中的限制因素,促进口腔黏膜渗透的物质称为渗透促进剂,口颊膜中常用的渗透促进剂包括表面活性剂(如十二烷基硫酸钠)、醇类(如丙二醇)、胆盐(如牛磺胆酸钠)、聚合物(如聚氧乙烯)等[12] 。适宜的增塑剂可降低口颊膜的玻璃化转变温度,提高柔韧性,改善机械性能[13] 。口颊膜中常用的增塑剂有丙二醇、柠檬酸、聚乙二醇(PEG400)等。有研究表明,处方中增塑剂与成膜材料的比例对膜剂的机械性能(断裂伸长率、杨氏模量、折叠耐久性)、厚度、溶出度等关键质量属性产生显著影响[14] 。辅料选择时应考虑选择合适的矫掩味技术,例如,甜味剂或矫味剂的使用,可使用体外评估方法(如电子舌)和/ 或成人口尝试验对口感进行初步考察;在临床研究阶段,在目标治疗人群中进行口感评估,收集依从性和觅药行为数据以验证口感设计的合理性。背衬层起阻隔和屏蔽的作用,减少唾液冲洗和吞咽引起的药物损失,以实现药物向口腔黏膜的单向释放。口颊膜中常用的水不溶性背衬层材料为乙基纤维素。
开发用于儿童人群的口颊膜时,应关注儿童用药开发指导原则[15] 相关要求。口腔黏膜制剂的正确使用和可接受性取决于儿童患者的年龄以及在规定的时间内维持制剂处于口腔特定部位的能力。应结合药物的使用位置进行口腔黏膜制剂的黏附性研究。对于儿童药物而言,味道是决定黏膜接触时间的重要因素之一,因此对于口感的评估更加应该关注。此外,选择合适的辅料是儿童药品药学开发中的关键要素之一,开发时应尽可能使用最少种类和最低用量的辅料,应关注潜在致敏或过敏性的辅料,评估辅料的在目标儿童人群使用的安全性。
2.2 生产工艺及过程控制
工艺开发时应对参照ICHQ8[11] 对生产工艺和工艺参数进行全面的筛选研究,以加强对产品性能和工艺的理解,建立工艺参数与制剂关键质量属性(如薄膜厚度、溶化时限、溶出度、黏附性、水分、含量和含量均匀度、机械性能等)之间的关系,并采取有效的过程控制措施。
膜剂的制备工艺主要包括涂膜法、热熔挤出法、半固体溶剂浇铸法、固体分散挤压法和滚圆法等[16] 。其中涂膜法是制备膜剂常用的方法,该方法制备工艺简单,加工成本低,易于使用[17] 。涂膜法首先将成膜材料溶解于水或有机溶剂或两者的混合溶剂中,形成具有一定黏度的透明状溶液。当药物活性成分为水溶性时,应与成膜材料制成具有一定黏度的溶液;当药物活性成分为水不溶或难溶时,应将其粉碎并与成膜材料等混合均匀。再将药物和其他辅料溶解或分散到上述溶液中,真空脱气,倒入涂膜机中涂膜,真空干燥除去水分,脱模后裁剪成所需规格,即得[18] 。
采用涂膜法制备双层口颊膜时,涂布工艺原理和关注点与单层膜相似。影响药品关键质量属性的高风险工艺步骤通常为配液、脱泡、涂布和干燥。应根据前期开发积累的知识和经验,根据不同工艺的风险点,对关键工艺参数进行研究和确认,并针对性地开展过程控制、中间体控制。此外,双层膜的制备需重点关注双层膜的组合方式。可先分别配制各层的涂布液,采用多次涂布的方式(第一层薄膜完全干燥后,再在第一层膜上面涂第二层)[19] ,或者分别涂布成膜后通过有机溶剂粘贴的方式组合[20] 。双层膜制备时应关注处方和工艺对每层薄膜的机械性能、均匀性的影响;当工艺中使用有机溶剂时,关注溶剂残留量。
2.3 包装
口颊膜自身特点导致可能对环境的湿度较为敏感,应选择阻隔性能符合要求的包装材料。常见的包装材料为中间隔铝的复合膜材料,单片独立包装。包装设计应能方便使用者使用,且在打开包装、运输和保存中能够确保膜的完整性[21] 。可选择易揭型复合膜或设计易撕口,必要时增加防儿童误开的设计。
2.4 质量研究
«中国药典»2020 年版(四部)0125膜剂通则中规定[22] ,膜剂外观应完整光洁、厚度一致、色泽均匀、无明显气泡。多剂量的膜剂,分格压痕应均匀清晰,并能按压痕撕开。除另有规定外,膜剂应进行重量差异(凡进行含量均匀度检查的膜剂,一般不再进行重量差异检查)、微生物限度(微生物计数法和控制菌检查法及非无菌药品微生物限度标准检查,应符合规定)的检查。国家药典委员会发布关于征求«中国药典»丸剂和膜剂通则修订草案公开征求意见[1] 中对膜剂在生产与贮藏期间的要求进行修订,增加了口感、口腔黏膜刺激性、水分、机械性能、微生物限度、溶出度、含量均匀度及残留溶剂方面的要求。
除常规口服制剂质量控制项目外,根据剂型的特点及关键质量属性,建议在处方工艺开发和研究中重点评价口颊膜的黏附性、水分、溶出度、溶化时限以及机械性能。
黏附性:包括黏附时间和黏附强度。黏附时间为口颊膜贴于口腔直至完全脱落或消失所需的时间。常用测定方法包括体外法和体内法。体外法是将口颊膜与贴在动物的新鲜口腔黏膜上,并在玻片上固定,放入烧杯或溶出杯,搅拌介质,记录开始至口颊膜分离或完全腐蚀的时间[21] 。体内法是将口颊膜黏附于健康成年志愿者颊黏膜处,评估其体内停留时间[23] 。黏附强度为分离口颊膜所需的最大力,反映口颊膜与口腔黏膜的黏附性。目前尚无统一的测定方法,可设计开发适宜的方法,测量将制剂从黏膜或黏膜模拟物上分离所需的力。
水分:口颊膜中应含有适量的水分,以保障口溶膜具有适宜的机械性能,建议设定水分的上下限,保证既不会因为水分过多导致膜产生粘连,也不会因为水分过少导致膜片变脆易碎。
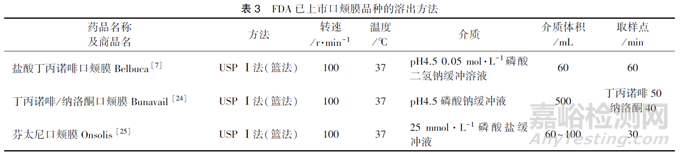
溶出度:溶出度可用于评估药物释放行为和制剂性能,应针对口腔黏膜生理环境设计和开发适宜的溶出方法。溶出度方法开发应关注但不限于:漏槽条件、设备和装置、溶出介质、搅拌转速等。应对所选溶出方法的区分力进行合理论证。表3 汇总了FDA 已上市口颊膜品种的溶出方法,对溶出方法的选择和开发具有一定参考价值。
溶化时限:建议模拟口颊膜使用方法及口腔环境,建立可行的溶化时限检查方法(少量溶剂),结合临床试验中在受试者口腔中的溶化时限及相关性考察,为方法及限度提供合理性依据。建议订入放行标准,酌情订入注册标准。
机械性能:应具有适宜的机械强度,以避免包装、运输、使用过程中发生磨损或破碎。机械性能的评价指标可包含但不限于抗拉强度、伸长率、抗撕裂性、杨氏模量、耐折度等[18] 。机械性能研究可助于指导处方工艺开发。
3、结语
作为口腔黏膜给药的代表性剂型之一,口颊膜与传统口服给药剂型相比,具有起效快、避免药物胃肠道降解和肝脏首过效应、提高患者依从性等优势。本文汇总了国内外药典对于口颊膜的定义和要求,汇总分析美国已批准上市产品,结合审评工作,重点对口颊膜处方工艺开发、质量研究和控制等方面进行探讨。处方开发重点关注成膜材料、渗透促进剂、增塑剂、背衬材料的选择;工艺研究根据各工艺风险点评估及口颊膜特性影响研究对关键工艺参数进行研究和确认,并针对性地开展过程控制和中间体控制,尤其关注两层膜的结合方式研究;质量研究应基于口颊膜特性,重点关注黏附性、水分、口感、溶出度以及机械性能等项目的研究。希望通过上述探讨,能够助力现阶段对此类产品的开发和评价,助推有临床价值的高质量口颊膜产品获批上市。
参考文献
[1] 国家药典委员会.征求«中国药典» 丸剂和膜剂通则修订草案意见.[EB/ OL].(2023-03-14) [2024-6-20].https:/ / www.chp.org.cn/ #/ business/ standard.
[2] SHIFA H,SHEELA Y,REESHA B,et al.Buccal film:anovel approach for oral mucosal drug delivery system[J].Asian J Pharm Clin Res,2021,14(1):27-35.
[3] FDA.205637 Orig1s000 Clinical Pharmacology and Biopharmaceutics Review(s)[EB/ OL].(2014-06-06)[2024-06-20].https:// www. accessdata. fda. gov/ drugsatfda _ docs/ nda/2014/205637Orig1s000ClinPharmR.pdf.
[4] JAGTAP V D.Buccal film a review on novel drug delivery system[J].Int J Res Rev,2020(7):17-28.
[5] MITUL P,ASIF K,PRATIK S,et al.Buccal drug delivery system:the current interest[ J]. IRJP,2011,3( 3): 291-303.
[6] FDA.FDA-Approved Drugs [ DB/ OL].[ 2024-6-20].https:/ / www.accessdata.fda.gov/ scripts/ cder/ daf/ .
[7] FDA.207932Orig1s000 Chemistry review(s) [EB/ OL].(2015-10-23)[2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ nda/2015/207932Orig1s000ChemR.pdf.
[8] FDA.Belbuca Label[EB/ OL].(2015-10-23)[2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/label/2015/207932s000lbl.pdf.
[9] FDA.Bunavail Label[EB/ OL].(2014-06-06)[2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/label/2014/205637s000lbl.pdf.
[10] FDA.Onsolis Label[EB/ OL].(2009-07-16) [2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/label/2009/022266s000lbl.pdf.
[11] The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use. Q8 Pharmaceutical Development[ EB/ OL].( 2009-08-01) [2024-06-20].https:/ / database.ich.org/ sites/ default/files/ Q8%28R2%29%20Guideline.pdf.
[12] 王双庆,左阿龙,郭建鹏.颊黏膜黏附膜的研究进展[J].中国现代应用药学,2022,39(1):134-140.
[13] LIM H, HOAG S W. Plasticizer effectson physical- mechanical properties of solvent cast SoluplusⒸ films[ J].AAPS PharmSciTech,2013,14(3):903-910.
[14] SONAL M,NARESH P,PRASHANTH M,et al.Quality by Design approach for studying the impact of formulation and process variables on product quality of oral disintegrating films[J].Int J Pharm,2017,527(1-2):151-160.
[15] 国家药品监督管理局药品审评中心.儿童用药( 化学药品)药学开发指导原则[ EB/ OL].(2020-12-31) [2024 - 06 - 20]. https:/ / www. cde. org. cn/ main/ news/viewInfoCommon/95102a5facaf8fd4430d0916a24eab53.
[16] 杨慧,何东升,李亚楠,等.口腔膜剂制备工艺的研究进展[J].药学研究,2018,37(7):413-415.
[17] RUKIYE S O,EMRAH O.Current Overview of Oral Thin Films[J].Turk J Pharm Sci,2021,18(1):111-121
[18] 王璐,胡延臣,王亚敏.口溶膜类新药的开发与评价探讨[J].药学研究,2024,43(3):302-307.
[19] ADAGIO 制药有限公司.舌下阿扑吗啡:201080035644[P].2012-05-30.
[20] CYNAPSUS 疗法有限公司.舌下薄膜:201180067683[P].2013-12-25.
[21] SHIFA H,SHEELA Y,REESHA B.Buccal film:a novel approach for oral mucosal drug delivery system[J].Asian J Pharm Clin Res,2021,14(1):27-35.
[22] 国家药典委员会.中华人民共和国药典2020 年版( 四部)[S].北京:中国医药科技出版社,2020.
[23] PARODI B, RUSSO E, BALDASSARI S, et al.Development and characterization of a mucoadhesive sublingual formulation for pain control:Extemporaneous oxycodone films in personalized therapy [ J]. Drug Dev Ind Pharm,2017,43(6):917-924.
[24] FDA.205637Orig1s000 Chemistry review(s) [EB/ OL].(2014- 06-06)[2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ nda/2014/205637Orig1s000ChemR.pdf.
[25] FDA.022266s000 Chemistry review(s) [EB/ OL].(2009-07-16) [ 2024-06-20].https:/ / www.accessdata.fda.gov/ drugsatfda _ docs/ nda/2009/022266s000 _ ChemR _P1.pdf.

来源:药学研究


