您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-12-05 08:19
2024年9月19日, FDA 发布重磅指南草案——Chemical Analysis for Biocompatibility Assessment of Medical Devices: Draft Guidance for Industry and Food and Drug Administration Staff(用于医疗器械生物兼容性评估的化学表征),该指导文件草案提供了FDA关于化学表征测试的建议,以评估医疗器械的生物相容性。同时鼓励制造商在将化学表征作为器械生物相容性评估的一部分时,考虑到本指南文件中讨论的事项,使用适合其特定目的的方法。
1、医疗器械进行化学表征的目的
如FDA的生物相容性指南Use of International Standard ISO 10993-1,‘Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process’,所述,生物相容性是通过风险管理过程进行评估的。生物相容性风险通过对器械的风险评估来确定的,然后使用相关信息(例如,文献、动物试验、经验、生物相容性测试)来减轻这些风险。
正如FDA认可的共识标准ISO 10993-18 Biological evaluation of medical devices - Part 18: Chemical characterization of medical device materials within a risk management process 所述,化学表征用于表征可能从医疗器械释放到人体内的化学物质,并且在生物相容性评估期间可用于解决某些风险。例如,当与目前 FDA 认可的ISO 10993-17 Biological evaluation of medical devices - Part 17: Toxicological risk assessment of medical device constituents 中所述的毒理学风险评估(TRA)一起使用时,化学表征可以作为评估某些生物相容性终点的生物学测试的替代方法。
此外,化学表征可以用来支持在评估器械材料或制造变更时的化学等效性测定。化学表征可以通过一次评估多个生物相容性终点减少完成生物相容性测试所需的时间,并且可以减少动物测试。
2、医疗器械化学表征的范围
由于医疗器械的多样性,并非所有医疗器械都需要表征所有参数,表征参数应与材料或成品医疗器械相适应,由临床暴露时间和接触性质决定。
3、化学表征实践流程
Step 1 器械组成和材料信息收集
★收集原材料的信息(例:化学成分、商品名、供应商、材料标准、技术指标、数据清单等)
★生产制造过程信息(例:生产过程的单体、交联剂、引发剂等)
★考虑材料的清洗、灭菌等因素
★准确描述器械的预期用途,并应考虑临床上相关的最坏暴露情况(例:每次使用数量、使用次数、每次使用的接触时间,描述器械材料是短期接触(<24h)、长期接触(1-30days)还是永久植入(>30days))
★器械组件信息(例:组件名称、尺寸、接触持续时间和类型(直接、间接、不接触)、材料组成)
Step 2 可沥滤物分析
1、浸提条件的选择
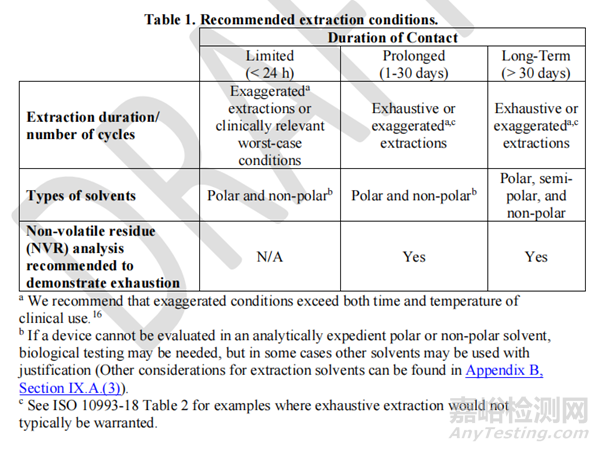
浸提条件应选择以获得器械中组织可能暴露的分析物量的最坏情况估计。提取的条件包括温度,不同极性的溶剂,溶剂体积,样品的比例及时间等。浸提条件见下表,表格来自FDA草案table1。
2、AET阈值的确定
AET:分析评估阈值,指在化学分析中,用于判断某一化学物质是否需要进行毒理学评估的最低浓度水平。即低于该阈值的可沥滤物,不需要定性或者定量,也无需进行毒理学评估。ISO 10993-18的标准中,使用基于剂量的阈值DBT来代替SCT,DBT是根据暴露时间,在TTC的基础上选择的,但是高毒性物质(如亚硝胺等)被排除在外,该类物质通常需要额外的目标物分析。
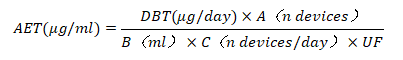
式中,
A(n devices):提取的医疗器械的数量
B(ml):提取液体积
C(n devices/day):临床每日最大使用的医疗器械数量
UF:不确定因子(FDA推荐GCMS为4,LCMS为10)
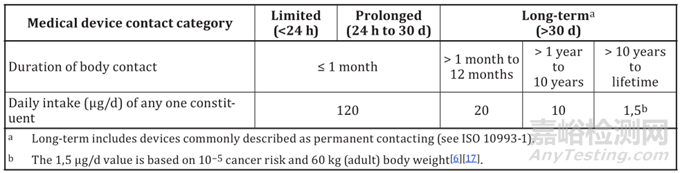
DBT(μg/day):安全评估阈值,基于医疗器械临床使用风险确定,取值见下表,表格来自ISO/TS 21726:2019(E)table 1。
3、非靶向分析
★确定好AET之后,即可根据阈值建立对应的分析方法。根据不同性质化合物的分类,即:挥发性有机化合物(VOC)、半挥发性有机化合物(SVOC)、非挥发性有机化合物(NVOC)、元素、离子,分别选择(顶空)气相色谱-质谱联用(HS-GC-MS\GC-MS)、液相色谱-质谱联用(UPLC-MS)、电感耦合等离子体质谱(ICP-MS)、离子色谱(IC)等检测技术手段进行未知可沥滤物的全扫描法非靶向半定量分析。
★在非靶向分析中,需要对所有超过AET的化合物进行定性分析,确定化合物的结构信息。未知物种类杂多,导致定性分析的过程难度高且复杂。对于GC-MS类仪器来讲,仍可依托与本身的NIST谱库进行鉴定,但LC-MS类仪器往往需要人工解谱以及样品的背景信息来获得更高的鉴定程度,或可以依托于高分辨质谱类仪器(TOF/QE)进行物质鉴定。
Step 3 毒理学评价
医疗器械的毒理学风险评估主要遵循ISO 10993-17,通过识别器械中可能存在危害的物质,比较这些物质在人体中的无不良反应剂量与相应的人体暴露量,最终判定其安全性风险是否可接受。
4、医疗器械相关参考法规
● ISO 10993-1: 2018, Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process
● ISO 10993-12: 2012, Biological evaluation of medical devices – Part 12: Sample preparation and reference materials
● ISO 10993-18: 2020, Biological evaluation of medical devices – Part 18: Chemical characterization of medical device materials within a risk management process
● ISO/TS 21726: 2019, Biological evaluation of medical devices- application of the threshold of toxicological concern (TTC) for assessing biocompatibility of medical device constituents
● GB/T 16886.1-2022, 医疗器械生物学评价-第1部分:风险管理过程中的评价与试验
● GB/T 16886.12-2017, 医疗器械生物学评价-第12部分:样品制备与参照材料
● GB/T 16886.18-2022, 医疗器械生物学评价-第18部分:风险管理过程中医疗器械材料的化学表征
● 医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿)
● YY/T 1815-2022, 医疗器械生物学评价-应用毒理学关注阈值(TTC)评定医疗器械组分的生物相容性
● ICH Q3D 元素杂质指导原则

来源:Internet


