您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2025-02-13 15:21
2024年,国家药监局以习近平新时代中国特色社会主义思想为指导,全面贯彻党的二十大和二十届二中、三中全会精神,按照“讲政治、强监管、保安全、促发展、惠民生”的工作思路,全面深化医疗器械审评审批制度改革,健全支持医疗器械创新发展机制,强化医疗器械注册质量管理,夯实医疗器械监管基础,加强监管能力建设,推动产业创新高质量发展。
一、医疗器械注册工作情况
(一)医疗器械监管法治建设稳步推进。2024年,国家药监局通过深入调研论证,广泛征求意见,完成《医疗器械管理法(草案送审稿)》,将为加快推进我国从制械大国向制械强国跨越提供更加坚实的法治保障。印发《医疗器械临床试验机构监督检查办法(试行)》及机构检查要点和判定原则,强化临床试验规范化管理。会同国家卫生健康委发布《医疗机构临床急需医疗器械临时进口使用管理要求》,进一步满足特殊情况下临床诊疗救治急需。研究修订《医疗器械临床试验项目检查要点和判定原则》,强化临床试验项目管理。研究修订《关于进口医疗器械产品在中国境内企业生产有关事项的公告》,进一步鼓励跨国企业在中国境内生产。
(二)创新医疗器械获批数量持续增长。2024年,国家药监局共批准创新医疗器械65个,优先审批医疗器械8个,创新医疗器械批准数量连续两年维持高位,获批产品的质量和数量取得双丰收。支气管导航控制系统、体外心室辅助设备、肾动脉射频消融仪等多款高端医疗器械上市,覆盖手术机器人、心肺支持辅助系统、人工智能等多领域。其中,心脏内超声成像系统、融合超声和光声成像技术的双模态超声成像产品、基于多病种算法设计的眼底图像辅助诊断软件、小型化集成型单室质子治疗系统等产品在国内首次获批,不仅为患者提供了更多治疗选择,还有效提升了临床手术的安全性和成功率,更好地满足人民群众使用高水平、高质量医疗器械的需求。选取医用机器人、人工智能医疗器械、高端医学影像设备和新型生物材料4个重点领域,研究全链条集成创新支持政策。3个猴痘病毒检测试剂获准注册,全力服务保障重大公共卫生需求。成立高端医疗装备创新合作平台,汇聚政产学研医各领域优势资源,加强颠覆性、原创性技术研究和科技成果转化。推进第一批人工智能医疗器械创新任务、生物医用材料创新任务揭榜挂帅工作,确定106个人工智能医疗器械优胜项目。
(三)国家重大区域战略稳步落实。大力支持粤港澳大湾区、海南自贸港、福建等重点区域建设。批准人工耳蜗声音处理器等3个海南临床真实世界应用试点产品上市,截至2024年底,累计批准产品12个,惠及更多患者。指导粤港澳大湾区使用48种、158批次港澳已上市的医疗器械,服务区域诊疗需要。批复福建省局对台湾地区产第一类医疗器械实施备案,支持福建探索海峡两岸融合发展新路。指导出台《北京市促进临床急需药械临时进口工作实施方案》《粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》,规范区域内临床急需医疗器械管理。
(四)医疗器械注册备案管理不断规范。开展“进省局、进企业、进医院,促创新、促规范、促提升”的“三进三促”专题调研,以点带面维护医疗器械注册备案工作秩序。组织召开医疗器械注册管理片区工作座谈会,分析研讨注册管理工作面临的形势和挑战。落实二类首个产品注册管理机制。召开第一类医疗器械备案管理工作现场会、第一类医疗器械备案工作联系点座谈会,细化工作指导,督促建立完善备案管理工作机制。各级药监局对第二类医疗器械注册信息和第一类产品备案信息实行月度、季度主动公开,接受社会监督。
(五)注册管理风险防控机制逐步完善。每季度召开注册备案问题风险会商会,会商研判管理类别或属性问题、规范性问题。临床试验检查力度持续加大,截至2024年底,临床试验机构备案共计1498个。各省级药品监管部门共开展机构检查885家次,比上年增加55.5%,占备案机构数量的59.1%。国家局分两批对50个在审品种开展临床试验现场检查和产品真实性核查,检查数量比2023年增加66%,有力发挥监督抽查震慑作用。
(六)医疗器械审评审批能力加速提升。组织开展省级医疗器械审评人员和审评机构能力评价,推动医疗器械审评审批能力提升。举办医疗器械注册法规与注册管理实务培训、12期线上和6期线下第二类医疗器械审评实训、临床试验监管和检查人员专题培训、体外诊断试剂分类网络专题培训等,系统内外累计培训11300人次。发挥官方网站和公众号信息发布平台作用,持续更新“器审云课堂”,已收录课程431个,不断提升政务服务水平。全年发布120项指导原则。推进监管科学行动计划第三批重点项目。
(七)医疗器械标准体系建设不断夯实。2024年,下达行业标准制修订计划项目100项,通过快速程序批准2项采用脑机接口技术的医疗器械相关行业标准立项,鼓励相关产品研发创新。批准发布医疗器械行业标准90项。2024年获批国家标准制修订项目33项,发布医疗器械国家标准49项。现行有效医疗器械标准2023项(国家标准296项、行业标准1727项)。统筹推进新版GB 9706系列标准实施。深入参与国际标准化工作,《人工智能医疗器械 肺部影像辅助分析软件 算法性能测试方法》等6项国际标准有序推进,我国主导制定的ISO 7151:2024《外科器械 非切割铰接器械通用要求和试验方法》国际标准获批发布;新增国际标准化组织注册专家144人,1名中国标准化专家获任ISO和IEC国际标准组织联络员,标准国际化进程稳步推进。
(八)医疗器械分类管理进一步细化。修订发布《体外诊断试剂分类目录》,设立一级产品类别25个,二级产品类别1852个,同步发布配套实施通告及解读,进一步强化体外诊断试剂分类指导,支持体外诊断试剂创新发展。修订发布《关于规范医疗器械产品分类界定工作的公告》,优化分类界定工作流程,提升分类界定工作质量和效率。针对近视控制、弱视治疗类产品、应用纳米材料的医疗器械等热点产品研究起草分类界定指导原则,加强交叉管理产品研究。启动《医疗器械分类目录》与通用名命名对应研究,推进衔接整合。选取部分植入类医疗器械开展医疗器械通用名称与医保通用名关联映射研究,强化三医联动。
(九)监管科学研究深入推进。组织推进新一代基因测序产品评价方法研究、数字疗法医疗器械质量评价方法研究等9个医疗器械上市前重点项目45个子项目研究工作,强化督促指导。加快推进全国药品监管科学重点实验室建设,开展脑机接口系统柔性电极安全性评价等12项检验方法研究。组织开展医疗器械企业合规能力建设探索研究,引导企业构建质量合规体系,探索建立医疗器械质量合规管理能力评估机制以及评估结果应用的可行路径。
(十)国际交流合作取得实质性进展。着力推动GHWP发展,积极履行主席义务,设立战略咨询委员会、组建能力建设委员会、成立审评互信实践特别工作组,进一步增进组织活力;已完成10项指南文件的制修订,为组织发展夯实支撑;在广州创立全球首家GHWP医疗器械培训学院,加快提升成员国家和地区的监管能力。积极参加IMDRF,跟进国际医疗器械监管最新进展,部署新项目研究,加快国际规则转化实施。
二、医疗器械注册申请受理情况
2024年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计13828项,与2023年相比增加4.3%。
(一)整体情况
受理境内第三类医疗器械注册申请7600项,受理进口医疗器械注册申请6228项。
按注册品种区分,医疗器械注册申请10271项,体外诊断试剂注册申请3557项。
按注册形式区分,首次注册申请3678项,占全部医疗器械注册申请的27%;延续注册申请4894项,占全部医疗器械注册申请的35%;变更注册申请5256项,占全部医疗器械注册申请的38%。注册形式比例情况见图1。
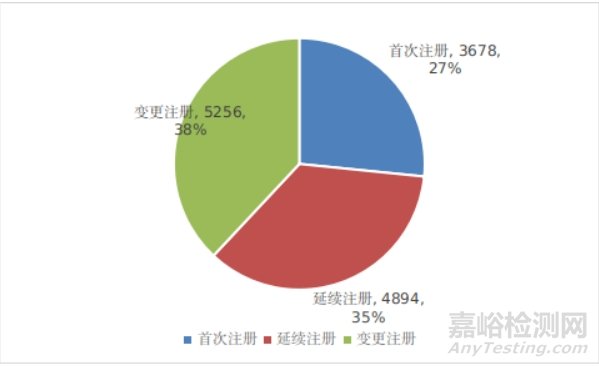
图1 国家药监局注册受理项目注册形式比例图
(二)分项情况
1.境内第三类医疗器械注册受理情况
境内第三类医疗器械注册受理共7600项,与2023年相比增加7%。其中,医疗器械注册申请5877项,体外诊断试剂注册申请1723项。
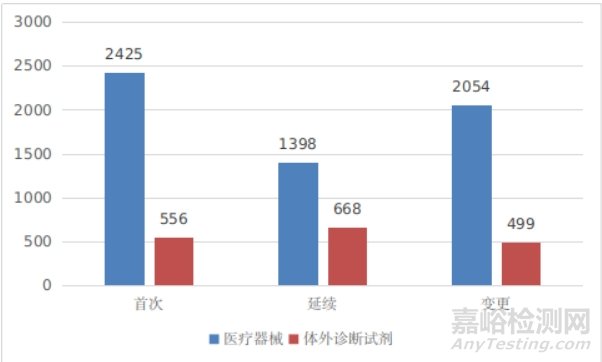
图2 境内第三类医疗器械注册受理项目注册形式分布图
从注册形式看,首次注册2981项,占全部境内第三类医疗器械注册申请数量的39.2%;延续注册2066项,占全部境内第三类医疗器械注册申请数量的27.2%;变更注册2553项,占全部境内第三类医疗器械注册申请数量的33.6%。注册形式分布情况见图2。
2.进口第二类医疗器械注册受理情况
进口第二类医疗器械注册受理共3295项,与2023年相比增加8.5%。其中医疗器械注册申请1805项,体外诊断试剂注册申请1490项。
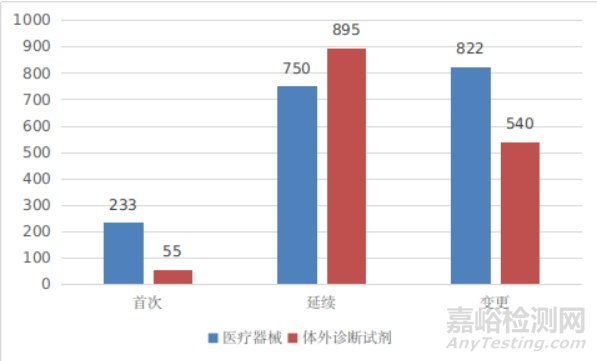
图3 进口第二类医疗器械注册受理项目注册形式分布图
从注册形式看,首次注册288项,占全部进口第二类医疗器械注册申请数量的8.7%;延续注册1645项,占全部进口第二类医疗器械注册申请数量的49.9%;变更注册1362项,占全部进口第二类医疗器械注册申请数量的41.4%。注册形式分布情况见图3。
3.进口第三类医疗器械注册受理情况
进口第三类医疗器械注册受理共2933项,与2023年相比减少5.9%。其中医疗器械注册申请2589项,体外诊断试剂注册申请344项。

图4 进口第三类医疗器械注册受理项目注册形式分布图
从注册形式看,首次注册409项,占全部进口第三类医疗器械注册申请数量的14%;延续注册1183项,占全部进口第三类医疗器械注册申请数量的40.3%;变更注册1341项,占全部进口第三类医疗器械注册申请数量的45.7%。注册形式分布情况见图4。
三、医疗器械注册审批情况
2024年,国家药监局共批准医疗器械首次注册、延续注册和变更注册13133项,与2023年相比注册批准总数量增长7.5%。
其中,首次注册3363项,与2023年相比大幅增加23.3%。延续注册4722项,与2023年相比减少1.4%,连续三年减少。变更注册5048项,与2023年相比增加7.5%。
2024年,企业自行撤回首次注册申请、自行注销注册证书380项。
近11年国家药监局批准医疗器械注册情况见图5。

图5 国家药监局2014至2024年度注册数据图
(一)整体情况
2024年,国家药监局批准境内第三类医疗器械注册6886项,与2023年相比增加11.9%,进口医疗器械6247项,与2023年相比增加3.1%。
按照注册品种区分,医疗器械9695项,占全部医疗器械注册数量的73.8%;体外诊断试剂3438项,占全部医疗器械注册数量的26.2%。
按照注册形式区分,首次注册3363项,占全部医疗器械注册数量的26%;延续注册4722项,占全部医疗器械注册数量的36%;变更注册5048项,占全部医疗器械注册数量的38%。注册形式比例情况见图6。
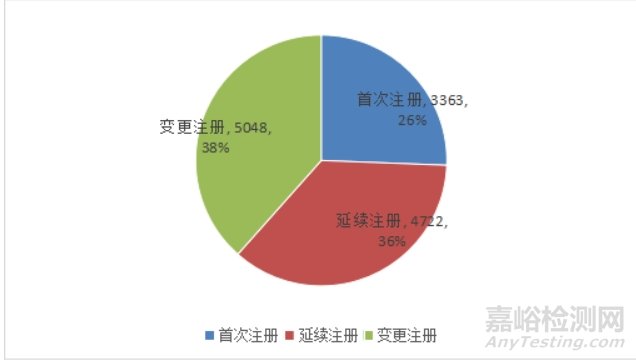
图6 国家药监局2024年注册形式比例图
(二)分项情况
1.境内第三类医疗器械注册审批情况
境内第三类医疗器械注册6886项。其中,医疗器械5272项,体外诊断试剂1614项。
从注册形式看,首次注册2655项,占全部境内第三类医疗器械注册数量的38.6%,延续注册1969项,占全部境内第三类医疗器械注册数量的28.6%;变更注册2262项,占全部境内第三类医疗器械注册数量的32.8%。注册形式分布情况见图7。
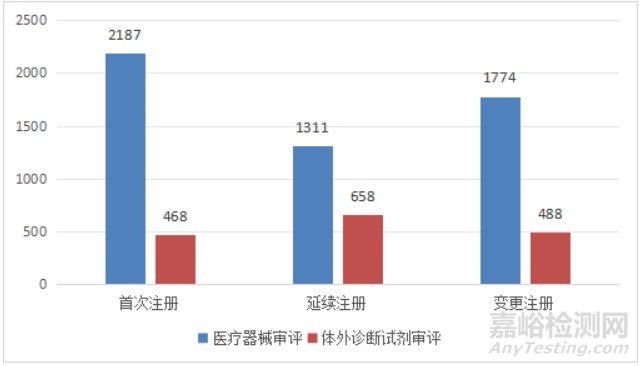
图7 境内第三类医疗器械注册形式分布图
2.进口第二类医疗器械注册审批情况
进口第二类医疗器械3228项。其中,医疗器械注册1745项,体外诊断试剂注册1483项。
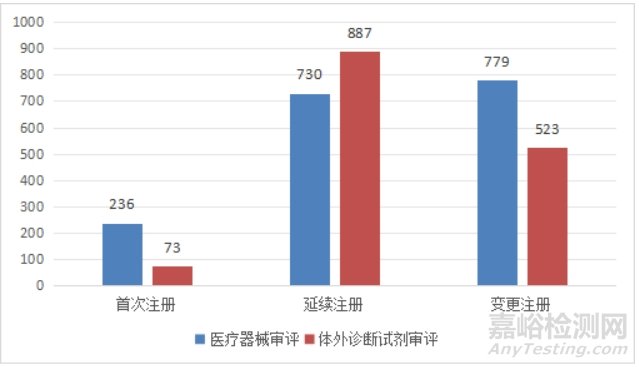
图8 进口第二类医疗器械注册形式分布图
从注册形式看,首次注册309项,占全部进口第二类医疗器械注册数量的9.6%;延续注册1617项,占全部进口第二类医疗器械注册数量的50.1%;变更注册1302项,占全部进口第二类医疗器械注册数量的40.3%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册3019项。其中,医疗器械注册2678项,体外诊断试剂注册341项。
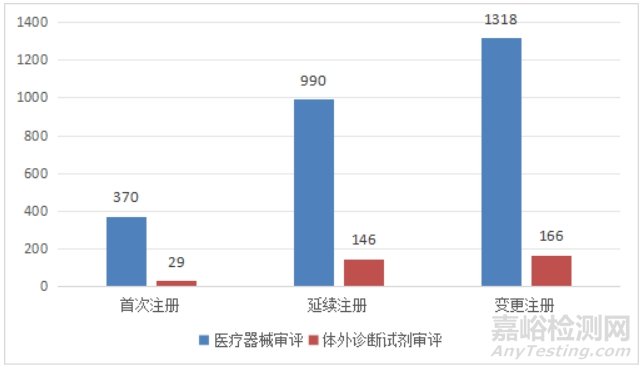
图9 进口第三类医疗器械注册形式分布图
从注册形式看,首次注册399项,占全部进口第三类医疗器械注册数量的13.2%;延续注册1136项,占全部进口第三类医疗器械注册数量的37.6%;变更注册1484项,占全部进口第三类医疗器械注册数量的49.2%。注册形式分布情况见图9。
(三)首次注册项目月度审批情况
2024年,国家药监局首次注册月度审批情况见图10。
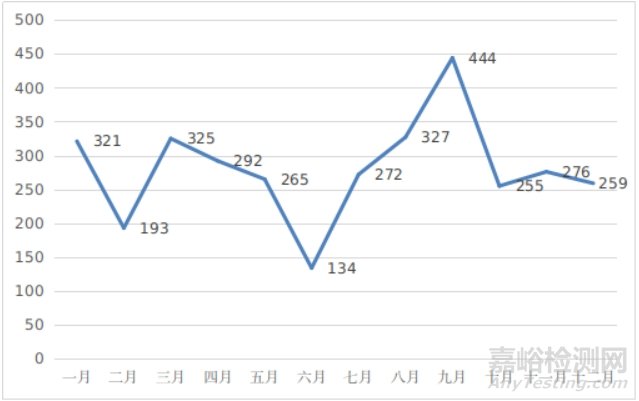
图10 首次注册项目月度审批图
(四)具体批准品种种类分析
注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。
注册数量前五位的境内第三类医疗器械是:无源植入器械,神经和心血管手术器械,有源手术器械,注输、护理和防护器械,口腔科器械。与2023年相比,有源手术器械超过注输、护理和防护器械,注册数量同比增加61.5%,口腔科器械超过医用成像器械进入前五位,其他品类注册数量也有所增加,如注输、护理和防护器械增加17%,神经和心血管手术器械增加8.4%,无源植入器械增加2.3%。

图11 境内第三类医疗器械注册品种排位图
注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中21个子目录的产品。

图12 进口医疗器械注册品种排位图
注册数量前五位的进口医疗器械,主要是:无源植入器械,口腔科器械,有源手术器械,眼科器械,有源植入器械,与2023年相比,变化较大,有源植入器械超过医用成像器械进入前五位,有源手术器械超过眼科器械,注册数量同比增加24.4%,其他品类注册数量略有增加。
(五)进口医疗器械国别情况
2024年,共有33个国家(地区)产品在我国获批上市。
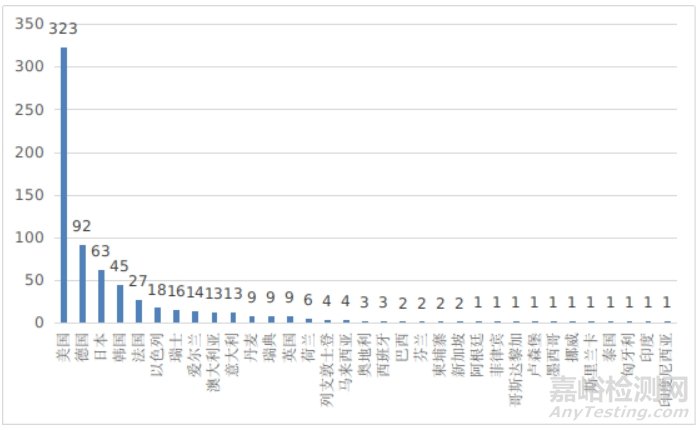
图13 进口医疗器械注册国别排位图
其中,美国、德国、日本、韩国、法国医疗器械在中国医疗器械进口产品首次注册数量位列前5位,注册产品数量约占2024年进口产品首次注册总数量的78%,与2023年相比略有增加。
从进口医疗器械代理人分布看,共有21个省涉及有本省企业作为进口医疗器械代理人,其中上海市代理人代理的进口首次医疗器械数量最多,占全部进口医疗器械数量的65%,与2023年相比略有增加。

图14 代理人代理的进口医疗器械数量省份排位图
(六)境内第三类医疗器械省份分析
从2024年境内第三类医疗器械注册情况看,相关注册人主要集中在沿海经济较发达省份。
其中,江苏、广东、北京、上海、浙江是境内第三类医疗器械首次注册数量排前五名的省份,占2024年境内第三类医疗器械首次注册数量的68%,与2023年相比基本持平。
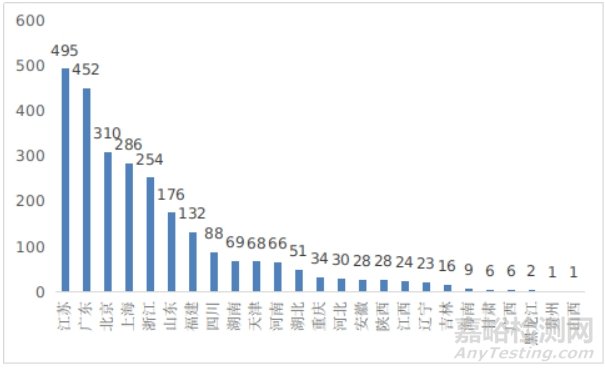
图15 境内第三类医疗器械注册省份排位图
四、创新医疗器械等产品注册审批情况
2024年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请451项,比2023年减少3.2%。
从2014年至2024年,国家药监局共批准315个创新医疗器械。其中境内创新医疗器械272个,涉及16个省的193家企业;进口创新医疗器械43个,涉及6个国家的24个企业。北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的315个创新医疗器械的75.9%,与2023年相比有所下降。
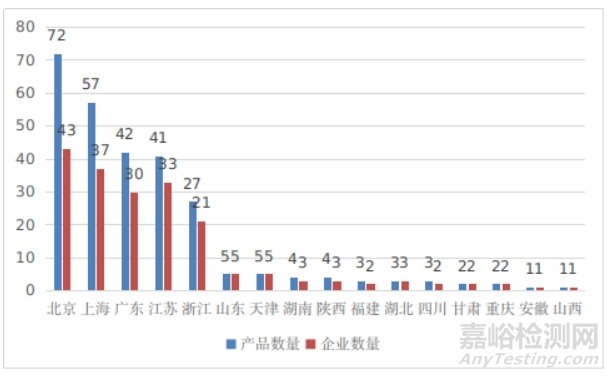
图16 境内创新医疗器械注册省份排位图
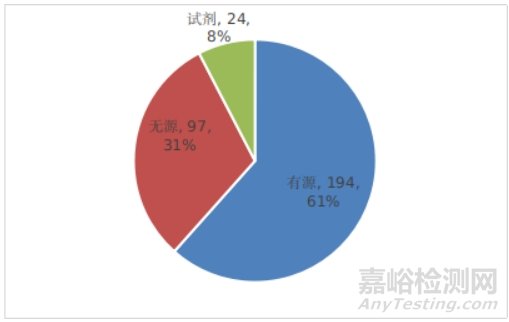
已批准的创新医疗器械中,有源产品占比约61%,无源产品约31%,体外诊断试剂产品约8%,具体见下图。
2024年,国家药监局共批准65个创新医疗器械产品上市,相比2023年增加6.6%。其中有源医疗器械45个,无源医疗器械17个,体外诊断试剂3个。
有源手术器械、无源植入器械、有源植入器械、医用软件、神经和血管手术器械以及医用成像器械等高端医疗器械是2024年批准的创新医疗器械数量前五位的品类,与2023年相比,神经和血管手术器械、有源植入器械增加较快。具体见图17。
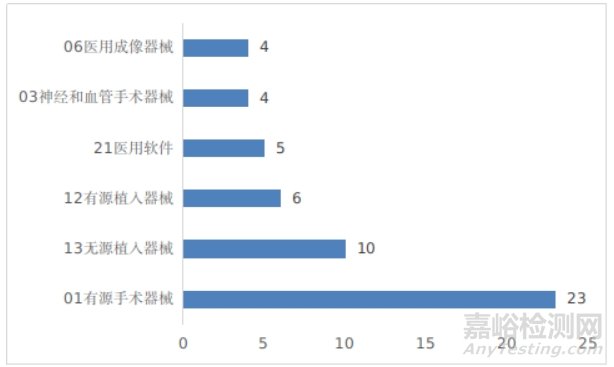
图17 创新医疗器械注册品种排位图
这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。以下是已批准创新医疗器械产品介绍:
(一)胃转流支架系统:该产品由输送系统和回收系统组成。输送系统由输送器、胃转流支架和导丝组成,胃转流支架预装在输送器的收纳管中。回收系统由回收管、回收钩和回收帽组成。该产品隔离食糜与肠道的接触,在转流期间作为一种辅助生活方式管理体重的产品,用于生活方式调整无效、无创治疗及药物治疗效果不佳的相关肥胖症患者。该产品在胃镜辅助下置入十二指肠及空肠上段,在不改动胃肠道生理结构的基础上达到类似胃旁路手术的效果,减少十二指肠和空肠大部分组织对食物中营养成分的吸收,达到减重目的,为肥胖症治疗提供新的选择。
(二)IFI44L基因甲基化检测试剂盒(PCR-熔解曲线法):该产品采用PCR熔解曲线法,对人体全血样本中IFI44L(干扰素诱导蛋白44L)基因启动子区域DNA甲基化水平定性检测,联合其他指标,可用于系统性红斑狼疮的辅助诊断。该产品由我国自主研发并拥有自主知识产权,可在系统性红斑狼疮患者出现重要器官受累前进行诊断,对于系统性红斑狼疮防治、改善患者的生活质量、提高患者生存率具有重要意义。
(三)颅内动脉瘤CT造影图像辅助检测软件:该产品由软件安装程序组成,包括浏览器端和服务器端,用于头颈动脉CT血管造影图像的显示、处理、测量和分析,对颅内3mm及以上动脉瘤进行辅助检测。该产品采用头颈血管中心线提取和血管分割技术,大大提高了颅内动脉瘤检出的敏感性,对于改善患者生活质量、提高患者生存率具有重要意义。
(四)一次性使用心脏脉冲电场消融导管:该产品由导管和连接电缆组成,与该公司生产的心脏脉冲电场消融仪配合使用,通过控制、释放适当强度的脉冲电场能量,有选择性地仅对需要治疗病灶部位的心肌细胞产生不可逆的电穿孔损伤,从而达到治疗房颤的目的。该产品为药物难治性、复发性、症状性、阵发性房颤的治疗提供了更多选择。
(五)支气管导航操作控制系统、支气管导航光纤定位导管、支气管导航可视化探头、支气管导航光纤定位导管导引器、支气管导航操作控制系统用无源器械和附件和支气管导航操作控制系统用针:上述产品配合使用,采用形状感知光纤技术进行支气管导航定位。与已上市同类产品相比,该产品光纤定位导管外径更小,可进入到更深的肺部气道,同时产品技术稳定、精准,不易受到干扰,可有效降低气胸和出血的并发症率,对于提高患者生存率具有重要意义。
(六)组合血糖仪:该产品由有创血糖检测模块、无创血糖检测模块、代谢热探头、环境温湿度监测模块和显示屏组成,作为现有指尖血糖监测的补充,适用于2型糖尿病患者日常自我血糖监测。该产品通过无创检测代谢热水平估算血糖浓度,属国内首创。糖尿病患者可通过测量口腔深部体温动态特征达到血糖测量的目的,有助于减少患者痛苦、减轻测量成本。
(七)寡糖链检测试剂盒(荧光毛细管电泳法):该产品系我国自主研发,采用毛细管电泳法对人体血清样本中的9个寡糖链进行定性检测,用于临床上乙肝肝硬化患者原发性肝细胞癌的辅助诊断。该产品通过非侵入性检测方法辅助诊断,有助于原发性肝细胞癌防治。
(八)体外心室辅助设备和体外心室辅助泵头及管路:体外心室辅助设备由磁悬浮马达、控制主机和配件组成,体外心室辅助泵头及管路由离心泵泵头、侧孔直通接头、鲁尔帽、管道夹和扎带组成。两产品联合使用,与血管相连形成旁回支路,通过控制主机和磁悬浮马达驱动泵头内叶轮悬浮转动,为血液增压提供动能,用于心脏术后患者临时体外机械循环辅助。该产品采用全磁悬浮血泵技术,具有抗振动、抗扭摆性能以及较好的血液流场设计,可有效降低血液相容性相关并发症的平均发生率。
(九)一次性使用多极肾动脉射频消融导管和肾动脉射频消融仪:一次性使用多极肾动脉射频消融导管由电极阵列、导管、导管手柄、导管连接电缆和矫直工具组成,肾动脉射频消融仪由发生器、遥控器、电源线和DVI-D电缆组成。上述两产品配套使用,射频消融仪可将射频能量经过导管电极传递至肾动脉血管内膜,利用电流热效应使肾动脉血管周围交感神经失活,阻断交感神经的兴奋传导,达到降低患者血压的目的。该产品通过物理方式阻断交感神经兴奋传导来降低血压,与传统药物治疗方式相比,可有效避免患者依从性、药物半衰期等因素影响,为难治性高血压患者提供了新的辅助治疗方式。
(十)植入式脑深部电刺激电极导线套件、双通道可充电植入式脑深部电刺激脉冲发生器套件、双通道植入式脑深部电刺激脉冲发生器套件和植入式脑深部电刺激延伸导线套件:上述产品是国产首个方向性脑深部电刺激产品,通过配套使用,可对丘脑底核或内侧苍白球进行刺激,用于对药物不能有效控制某些症状的晚期左旋多巴反应性帕金森病患者进行联合治疗。与传统电极相比,上述产品可为目标核团的特定功能亚区提供方向性刺激,同时在电极轻微植偏的情况下可避免脑深部刺激的副作用,减少再次手术植入电极的风险。
(十一)肺动脉取栓支架系统:肺动脉取栓支架系统由肺动脉取栓装置和血栓抽吸导管两部分组成。肺动脉取栓装置由输送鞘管和连有自膨式网篮结构的推送管同轴组装而成;血栓抽吸导管由抽吸导管、导管芯和抽吸器组成。用于有下述情况之一的急性高危肺栓塞或伴临床恶化的中危肺栓塞的经导管血栓清除治疗:有肺动脉主干或主要分支血栓,并存在高出血风险或溶栓禁忌的患者;有肺动脉主干或主要分支血栓,并经溶栓或积极的内科治疗无效的患者。该产品是国内首创介入治疗的肺动脉取栓支架系统。该产品采用机械取栓的方式,减少了溶栓药物的使用,也为具有溶栓禁忌症的患者提供了治疗选择。
(十二)经颈静脉肝内穿刺器械:经颈静脉肝内穿刺器械由通芯针、穿刺套管、导向器、导引内管、外鞘管、长扩张器、短扩张器组成。产品经环氧乙烷灭菌,一次性使用。用于经颈静脉肝内门静脉穿刺,进行门静脉的肝内分流手术,以降低门静脉压。该产品首创金属一体柔性针,易穿刺难变形;变径技术的首次应用,进一步提高产品整体的穿刺性能并减小穿刺创伤;亲水涂层技术在经颈静脉穿刺器械上的首次应用,降低推送阻力、提高产品推送性能。该产品提升手术效率,一定程度上减少并发症,提高安全性。
(十三)一次性使用射频房间隔穿刺针:一次性使用射频房间隔穿刺针由带射频穿刺电极头的导管和控制手柄连接组成,经股静脉入路与该公司生产的射频发生器及可调弯导管鞘配套使用,用于计划接受经房间隔穿刺路径进行心内科介入治疗的患者,通过从右心房行房间隔穿刺至左心房并建立二者之间的通路,辅助后续的介入治疗器械顺利进入左心房。该产品与传统机械性房间隔穿刺产品相比,采用射频能量穿刺,所需施加机械力更少,穿刺过程更加可控;远端采用可弯曲柔性材质,配合其他可调式器械使用,可精确调整角度到达目标组织,避免对非目标组织造成伤害;流体通道出口更接近电极头,穿刺更精准、安全;手柄具备能量控制开关,较脚踏开关反应时间更短,提升房间隔穿刺手术的成功率和安全性。
(十四)眼底病变眼底图像辅助诊断软件:眼底病变眼底图像辅助诊断软件包含客户端和服务器端,其中服务器端软件包括用户注册与登录模块、患者信息管理模块、基于深度学习算法的图像自动分析模块(包含图像质量判定模块和眼底多病种识别模块)、报告生成和管理模块和系统管理模块。该产品为首个基于多病种算法设计的眼底图像辅助诊断软件。与单病种算法相比,该产品采用单一网络模型即可判断是否存在眼底异常,进而对多种常见眼底疾病进行识别。该产品可以辅助医生实施多种眼底疾病综合检查,与单病种辅助诊断产品相比,其适用范围更广,可进一步提升基层医疗机构常见眼底病诊断能力,促使更广泛人群能够接受早期检查和诊疗,减少视力损伤和致盲性疾病的发生,降低相关疾病带来的社会负担。
(十五)冷冻消融仪:该产品由主机、气体延长管和球囊导管尾线组成,与特定球囊型冷冻消融导管联合使用,用于成人患者药物难治性、复发性、症状性的阵发性房颤治疗。相较于在我国已上市的国内、外同类产品,该产品使用的“冷量可调”和“复温提醒”技术具有首创性。“冷量可调”技术可实时监测冷冻温度,在保证冷冻消融治疗效果的基础上减少对临近组织的损伤。“复温提醒”技术可以降低提前回缩球囊产生的患者心肌损伤、球囊入鞘困难等临床和操作风险。
(十六)一次性使用心脏脉冲电场消融导管和心脏脉冲电场消融系统:一次性使用心脏脉冲电场消融导管由心脏脉冲电场消融导管和导管连接电缆组成,心脏脉冲电场消融系统由脉冲电场消融仪、记录模块及附件电缆组成。上述两个产品配合使用,用于患者药物难治性、复发性、症状性的阵发性房颤治疗。该产品利用脉冲电场的非热效应原理进行房颤治疗,可实现对心肌组织的选择性破坏,避免温度传递导致的周围组织损伤风险。
(十七)髂静脉支架系统:该产品由支架和输送器组成,支架预装在输送器内,支架为自膨式镍钛合金支架,显影点材料为钽,输送器由鞘芯、鞘管接头、止血阀、手柄和尾柄组成。产品经环氧乙烷灭菌,一次性使用。该产品预期在髂总静脉内使用,用于治疗非血栓性髂静脉压迫综合征。该产品通过静脉支架近端斜口、喇叭口设计,中段开环设计,支架分段式设计,提高产品性能,以满足临床需求。
(十八)便携式超声诊断仪和一次性使用心腔内超声成像导管:便携式超声诊断仪由超声主机、连接器和电源适配器组成。一次性使用心腔内超声成像导管由导管头端、可调弯管、操作手柄和尾部连接器组成,利用逆压电效应将便携式超声诊断仪输出的脉冲电信号转变为超声波发射至心脏腔内组织,并接收回波信号传递至便携式超声诊断仪,转为数字图像信号后在显示器上呈现。上述两个产品配合使用,用于对成人心脏及心脏大血管、心内解剖结构进行超声成像,与同类产品相比,具有更大探测深度,且为国内首个心腔内超声成像系统。
(十九)生物可吸收雷帕霉素洗脱冠脉支架系统:该产品由药物支架和输送系统组成。支架由支架基体、显影标记、药物涂层三部分构成,支架基体材料为左旋聚乳酸(PLLA),在支架近远端各有一个显影标记物,雷帕霉素药物涂层喷涂于支架外表面单面。输送系统为快速交换式球囊扩张导管。该产品经辐照灭菌,一次性使用,改善冠状动脉腔内直径,适用于冠脉原发病变导致的缺血性心脏病患者。该产品采用了单面药物涂层技术,通过点涂工艺仅在支架外表面涂敷药物,支架杆侧面及内表面无药物涂层,提高了药物利用率,有利于血管内皮化进程。
(二十)肾动脉射频消融仪和一次性使用肾动脉射频消融导管:肾动脉射频消融仪由主机、脚踏开关、手控器、中性电极电缆、等电位均衡导线和电源线组成。一次性使用肾动脉射频消融导管由消融导管和连接电缆组成。肾动脉射频消融仪通过单通道输出射频能量,经过导管电极传递至肾动脉血管内膜,利用电流热效应使肾动脉血管周围交感神经失活,阻断交感神经兴奋传导。同时,导管电极可输出电刺激信号对肾动脉进行标测,通过血压变化识别交感神经,实现选择性消融。该产品适用于难治性高血压和药物不耐受高血压辅助治疗中,对药物使用有减量需求的高血压患者。该产品为全球首款可标测肾神经的肾动脉射频消融类产品,能够为肾交感神经去除术提供准确消融位置,还可在术中、术后提供有效反馈,以评判肾交感神经去除术的即时效果,满足去肾神经术在临床实践中的需要。
(二十一)肾动脉射频消融仪及一次性使用网状肾动脉射频消融导管:肾动脉射频消融仪由主机、脚踏开关、主机连接线、中性电极连接线以及电源线组成。一次性使用网状肾动脉射频消融导管由网篮支架、消融电极、保护鞘、手柄、接插件组成。上述两个产品配套使用,用于辅助治疗难治性高血压及药物不耐受的高血压患者。一次性使用网状肾动脉射频消融导管具有螺旋式排布的六个电极,能够有效提高消融效率,网篮状设计使消融时血流不被阻断,在国内及国际上均属独创。肾动脉射频消融仪采用的温度、阻抗测量及反馈控制算法,使手术操作更加简便。该产品上市有利于射频消融技术的临床应用推广,可进一步降低临床治疗费用,使更多难治性高血压及药物不耐受的高血压患者受益。
(二十二)球囊型冷冻消融导管:该产品由球囊型冷冻消融导管、手动回缩器组成,与特定冷冻消融仪联合使用,用于治疗成人患者药物难治性、复发性、症状性的阵发性房颤。该产品所用“32mm大球囊”和“8mm短头”设计,可以稳定控制制冷剂流量,有效控制冷冻温度,且可贴近肺静脉口,有效采集肺静脉电位,从而保证冷冻消融效果。相较于在中国上市的国内、国外同类产品,该技术具有首创性。该产品上市可进一步满足我国在阵发性房颤治疗领域的临床需求。
(二十三)经导管主动脉瓣膜系统:该产品由经导管主动脉瓣膜、经导管主动脉瓣膜输送系统(包括输送器和瓣膜载入器)、主动脉瓣球囊扩张导管、压握装置及球囊充压装置组成。经导管主动脉瓣膜系统是国产首款球囊扩张式经导管主动脉瓣膜产品,适用于经心脏团队结合评分系统评估后认为患有有症状的、钙化的、重度退行性自体主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜、年龄大于等于70岁的患者。在医学影像设备监护下,该产品通过股动脉经导管植入到人体主动脉瓣环处,代替原有的病变主动脉瓣膜,改善病变部位狭窄,改善心功能。
(二十四)静脉支架系统:该产品由静脉支架及输送系统组成,预期在髂股静脉内使用,用于治疗非血栓性髂静脉压迫综合征、深静脉血栓形成及深静脉血栓形成后综合征。其中,支架采用一体化编织方法,具有不同网孔密度,疏密网孔相结合的设计可有效满足临床上对支架的支撑力和柔顺性需求。
(二十五)经导管主动脉瓣系统:该产品由生物瓣膜、输送器、球囊扩张导管、导管鞘套件、压握器、充压泵组成。采用球囊扩张式瓣架结构,适用于经心脏团队结合评分系统评估后认为患有有症状的、钙化的、重度退行性自体主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜、年龄大于等于70岁的患者。在医学影像设备监护下,可选择性通过长、短两款输送系统经由不同入路将生物瓣膜植入到人体主动脉瓣环处,代替原有的病变主动脉瓣膜,改善病变部位狭窄,改善心功能,满足不同入路患者临床需求。
(二十六)血管斑块旋切控制装置和一次性使用外周血管斑块旋切导管:血管斑块旋切控制装置由主机和电源线组成。一次性使用外周血管斑块旋切导管由电动导管、空间分离舱和可拆卸激活手柄组成。上述两个产品配套使用,用于股腘动脉原发性病变的经皮腔内斑块旋切预处理治疗。与传统斑块切除器械相比,该产品采用旋切结合主动抽吸的创新设计,实现了斑块切除及主动抽吸-灌注功能,在提供更有效的斑块切除疗效的同时,将斑块颗粒通过抽吸系统排出体外,减少远端栓塞等不良事件的发生。
(二十七)乙型肝炎病毒表面抗原(HBsAg)检测试剂盒:乙型肝炎病毒表面抗原(HBsAg)检测试剂盒由抗体结合粒子、酶标记抗体、样本处理液组成,用于体外定性和定量检测人血清或血浆中的乙型肝炎病毒表面抗原(HBsAg)。与已上市同类产品相比,该产品具有较高灵敏度,能够在乙型肝炎病毒感染者感染初期,体内血液中乙肝病毒表面抗原浓度较低时检测出相应抗原,实现早诊断、早治疗。
(二十八)导航定位微波消融系统:导航定位微波消融系统由主控台车(含机械臂、脚踏开关)、微波治疗台车(含光学跟踪模块、脚踏开关)、导航定位工具、微波传输线、一次性使用微波消融针及一次性使用测温针组成。该产品可在术前基于CT图像制定进针计划,术中引导微波消融针进行经皮穿刺手术,用于成人肝脏实体肿瘤的微波消融。与传统微波消融设备相比,该产品创新性地融合了导航定位技术、呼吸跟踪技术和微波消融技术,为国际首创,有效提高临床微波消融针置针、病灶靶区消融的精准度以及消融手术效率和成功率,降低对医生穿刺、消融规划经验的要求,提高穿刺消融治疗的有效性和安全性。
(二十九)心脏脉冲电场消融仪和一次性使用心脏脉冲电场消融导管:心脏脉冲电场消融仪由发生器、控制器(可选)、脚踏开关(可选)、EGM线缆、一次性使用导管接口线缆组成。一次性使用心脏脉冲电场消融导管由电极、管身和手柄组成。上述两个产品配套使用,利用脉冲电场的非热效应原理,治疗药物难治性、复发性、症状性阵发性房颤或药物难治性、复发性、症状性持续性房颤(发作持续时间小于1年)。与传统的射频消融及冷冻消融产品相比,该产品可实现对心肌组织的选择性破坏,避免温度传递导致的周围组织损伤风险。
(三十)颅内动脉瘤CT血管造影图像辅助检测软件:该产品由软件安装程序和授权文件组成,功能模块包括浏览器端、服务器端,用于头颈动脉CT血管造影图像的显示、处理、测量和分析,可对颅内3mm及以上动脉瘤进行辅助检测。该产品采用基于深度学习的头颈血管分割分段技术和多尺度动脉瘤检测技术,有效提高了颅内动脉瘤的诊断准确性和效率,对提升患者生存率具有重要意义。
(三十一)膝关节假体系统:该产品由股骨部件、胫骨部件和髌骨部件组成,适用于骨骼发育成熟患者的初次膝关节置换术。其中,股骨髁及胫骨托与骨结合界面均复合有采用增材制造工艺制作的骨小梁多孔结构,具有高摩擦系数和良好的骨结合性能。
(三十二)颅内动脉瘤栓塞辅助支架:该产品由支架、输送导丝和导入鞘三部分组成,其中支架部分由镍钛合金管材经激光雕刻而成,在支架两端及部分型号中部有铂铱显影点,便于临床精准判断支架打开及贴壁情况。在临床标准介入手术操作条件下,根据血管造影术来确定颅内动脉瘤位置,用于颅内动脉瘤患者血管内辅助栓塞和重建血流。
(三十三)脑外科手术计划软件:该产品由软件安装程序和授权文件组成,功能模块包括:用户登录、患者序列管理、手术计划、图像配准、三维重建、头架参数计算、纤维束生成,用于制定脑外科手术计划。该产品采用多维度空间血管重建和规避技术,通过结合现有头架工具和规划路径,可实现手术路径的优化,提高临床工作效率。该技术达到国际先进水平,具有首创性。
(三十四)植入式脑深部神经刺激电极:该产品由电极与颅孔电极锁盖及补充工具包、隧道工具、扭矩扳手和连接电缆组成,通过传导电刺激脉冲,实现对双侧丘脑底核和苍白球内侧部刺激,用于中晚期左旋多巴反应性帕金森病症状进行辅助治疗。该产品采用端头电极、方向性电极与多重独立电流相结合的技术,可有效增加脑深部电刺激术治疗窗、提升靶点定位精度和治愈率,减少再次手术植入电极的风险。
(三十五)氧化锆陶瓷股骨头:该产品为髋关节假体组件,由氧化锆陶瓷材料制成,与同企业同系列组件配合,适用于髋关节置换。该产品采用高低温循环烧结技术,降低了烧结的高温温度,既为晶界扩散提供驱动力,又可避免高温温度过高引起的性能不佳问题。与金属股骨头相比,氧化锆陶瓷股骨头的化学惰性可有效避免金属离子释放,减少假体松动问题发生,同时还具有更好的生物相容性。
(三十六)植入式心脏起搏电极导线:该产品由电极导线及附件组成,联合配套的心脏起搏器构成一个植入式心脏起搏系统,主要用于心房和心室的起搏和感知。该产品可有效降低MRI扫描时心肌组织的温升,更好满足心律失常患者临床1.5T磁共振成像检查需求。
(三十七)超声诊断系统:该产品由主机、探头和选配件组成,在线阵探头基础上同步输出近红外激光,使被测组织受热膨胀产生特定频率的超声信号,并将其强度和特征转化为图像显示,获得被测区域组织中血氧分布情况,用于临床超声和光声诊断检查。该产品为国内首个融合超声和光声成像技术的双模态成像产品,可在一个成像周期内,同时显示超声组织结构图像和光声图像,为医生诊断患者病情提供更丰富的组织结构和功能信息。
(三十八)陡脉冲治疗设备和一次性使用陡脉冲消融针:陡脉冲治疗设备由主机、电动悬臂机构、脚踏开关组成,与一次性使用陡脉冲消融针及连接线组配套使用。陡脉冲治疗设备采用纳秒高压脉冲电场发生装置,利用线性调制技术,通过脉冲成形网络存储能量并形成脉冲,具有电场强度高、脉宽短的特性,属于国内首创。通过非热消融技术,使消融针经皮穿刺作用于靶区,产生高压脉冲电场,使细胞产生不可逆的穿孔效应、快速凋亡,实现肝脏恶性实体肿瘤消融。该技术属于微创介入类肿瘤治疗的新技术,对于改善患者生活质量、提高患者生存率具有重要意义。
(三十九)质子治疗系统:该产品由加速器子系统和治疗子系统组成,其中加速器子系统包括离子源、磁铁单元、射频单元、真空单元、水冷单元、束流引出单元;治疗子系统包括旋转机架、治疗头、图像引导及配准系统、治疗控制台、放射治疗计划系统、激光定位系统等。通过提供质子束进行放射治疗,适用于全身实体恶性肿瘤及三叉神经痛等良性疾病。该产品是我国首台小型化集成型单室质子治疗系统,具有低成本、小体积、快速扫描和高集成度等特性。该产品采用适应性孔径技术,在提升影像清晰度的同时,对凹凸以及岛块组织结构的适应能力增强,可实现高精度和高适应性治疗,使更多患者获益。
(四十)心脏脉冲电场消融仪:心脏脉冲电场消融仪由主机、隔离电源、脚踏开关和附件线缆组成,附件线缆包括:三维定位设备连接线、串行计算机接口电缆、阻抗监控连接电缆、接地电缆。该产品与一次性使用脉冲电场消融导管配合使用,主要用于房颤治疗。该产品采用脉冲电场消融技术,通过控制脉冲电场能量,对病灶部位组织进行选择性治疗,使心肌细胞产生不可逆的电穿孔损伤,从而达到治疗目的。该技术可有效降低周边正常组织的热损伤风险,使更多药物难治性、复发性、症状性、阵发性房颤的患者受益。
(四十一)人工血管:该产品用于动静脉瘘的建立。产品结构为三层复合型结构,可减少术中渗血,具有较好缝合强度,使用过程中不易变形或扭折,预期有助于改善植入后的通畅性。
(四十二)主动脉覆膜支架破膜系统:该产品是体内原位开窗技术的破膜工具,与同公司已经过验证的主动脉弓主体支架系统配合使用,适用于治疗需要重建左锁骨下动脉血运的Stanford B型夹层患者,用于体内支架原位开窗。
(四十三)肠息肉电子下消化道内窥镜图像辅助检测软件:该产品采用U盘形式单机安装使用,由用户模块、管理模块、影像采集与显示模块、区域采集控制模块、自动标识模块、算法模块和基础模块组成,主要用于成人结肠内窥镜检查。该产品采用双流融合深度卷积神经网络算法,可实现手术过程中的动态信息实时显示,具有低延迟、高精度优势,能够为患者提供更高效高质量的辅助检测服务。
(四十四)质子治疗系统:该产品由加速器子系统和治疗子系统组成,其中加速器子系统包括主加速器系统、能量选择系统和射束传输系统,治疗子系统(含4个治疗室)包括360°旋转束治疗系统和治疗计划系统。该产品提供质子束进行放射治疗,适用于治疗全身实体恶性肿瘤及某些良性疾病,具体适应证应由临床医师根据实际情况确定。
(四十五)旋磨介入治疗仪和一次性使用冠脉旋磨导管:旋磨介入治疗仪由主机和电源线组成,一次性使用冠脉旋磨导管由旋磨导管和旋磨推进器组成,二者联合使用,主要用于原发性冠状动脉严重钙化病变的预处理。该产品属于国内首创,采用变径双向旋磨技术,利用偏心结构的旋磨头,通过调节旋转速度改变离心力控制旋磨直径,减少术中器械切换,实现降低介入创伤和提升管腔修饰效果的目的,有效提高患者血管介入治疗的成功率。
(四十六)一次性使用磁电定位压力监测脉冲电场消融导管:该产品由头端、管身、手柄、连接线缆和光电混合插头组成,与上海宏桐实业有限公司的心脏脉冲电场消融仪配合使用。该产品采用脉冲电场消融技术,通过控制脉冲电场能量,实现对病灶部位的心肌细胞选择性治疗,使其产生不可逆的电穿孔损伤,有效减少手术中无效消融或心肌穿孔,为药物难治性、复发性、症状性、阵发性房颤的治疗提供更多选择。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
2024年,各省级药品监管部门共批准境内第二类医疗器械注册35821项,与2023年相比增加6.7%。其中,首次注册14098项,与2023年相比增加1%,占全部境内第二类医疗器械注册数量的39.4%;延续注册10577项,与2023年相比增加12.1%,占全部境内第二类医疗器械注册数量的29.5%;变更注册11146项,与2023年相比增加9.3%,占全部境内第二类医疗器械注册数量的31.1%。
2024年各省共注销1423个注册证。境内第二类医疗器械分项注册情况见图18。
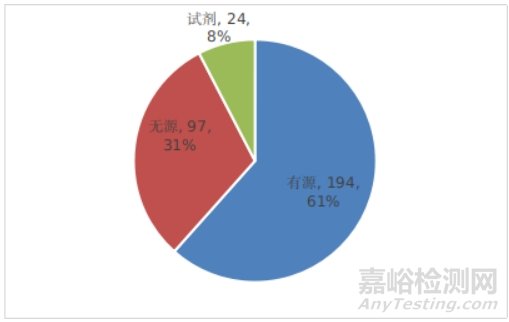
图18 境内第二类医疗器械注册形式比例图
从注册情况看,广东、江苏、北京、浙江、河南、湖南、山东、重庆、上海、湖北10省(市)办理境内第二类医疗器械注册事项较多。
|
省份 |
首次注册 |
延续注册 |
变更注册 |
总计 |
|
北京 |
656 |
1138 |
2096 |
3890 |
|
天津 |
313 |
275 |
422 |
1010 |
|
河北 |
456 |
373 |
358 |
1187 |
|
山西 |
240 |
84 |
64 |
388 |
|
内蒙古 |
7 |
7 |
10 |
24 |
|
辽宁 |
113 |
107 |
118 |
338 |
|
吉林 |
516 |
237 |
163 |
916 |
|
黑龙江 |
109 |
49 |
15 |
173 |
|
上海 |
429 |
711 |
445 |
1585 |
|
江苏 |
1926 |
1293 |
855 |
4074 |
|
浙江 |
973 |
1054 |
802 |
2829 |
|
安徽 |
238 |
145 |
194 |
577 |
|
福建 |
231 |
166 |
170 |
567 |
|
江西 |
269 |
136 |
372 |
777 |
|
山东 |
813 |
871 |
379 |
2063 |
|
河南 |
1042 |
694 |
868 |
2604 |
|
湖北 |
617 |
296 |
398 |
1311 |
|
湖南 |
1337 |
422 |
549 |
2308 |
|
广东 |
1758 |
1542 |
1571 |
4871 |
|
广西 |
463 |
156 |
213 |
832 |
|
海南 |
153 |
28 |
29 |
210 |
|
重庆 |
517 |
257 |
415 |
1189 |
|
四川 |
423 |
211 |
362 |
996 |
|
贵州 |
69 |
97 |
31 |
197 |
|
云南 |
94 |
44 |
54 |
192 |
|
西藏 |
8 |
0 |
0 |
8 |
|
陕西 |
220 |
87 |
133 |
440 |
|
甘肃 |
26 |
59 |
16 |
101 |
|
青海 |
27 |
4 |
14 |
45 |
|
宁夏 |
22 |
6 |
10 |
38 |
|
新疆 |
23 |
5 |
3 |
31 |
|
兵团 |
10 |
23 |
17 |
50 |
表1 境内第二类医疗器械注册表
第二类医疗器械注册具体数据见表1及图19。
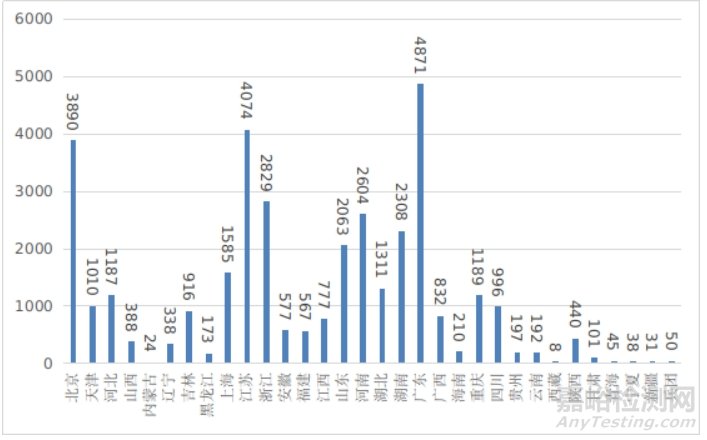
图19 各省第二类医疗器械注册数据图
从首次注册情况看,江苏、广东、湖南、河南、浙江、山东、北京、湖北、重庆、吉林10省(市)首次注册的境内第二类医疗器械数量较多。各省第二类医疗器械首次注册数量排位图见图20。
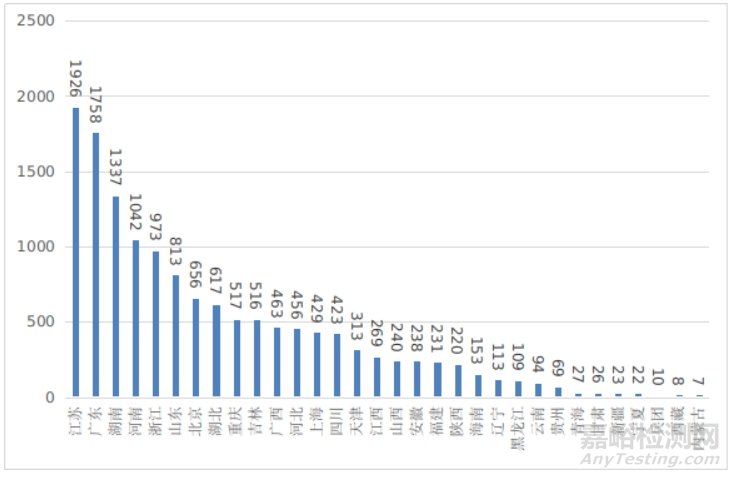
图20 各省第二类医疗器械首次注册数量排位图
(二)第一类医疗器械备案情况
2024年,国家药监局依职责共办理进口第一类医疗器械备案数量2151项,与2023年相比减少12.3%。
2024年,全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量22855项,与2023年相比减少11%,已连续两年减少。此外,2024年各省取消第一类医疗器械备案13342项。其中江苏、广东、浙江、山东、河南是第一类备案数量前五的省份。各省第一类医疗器械备案排位图见图21。
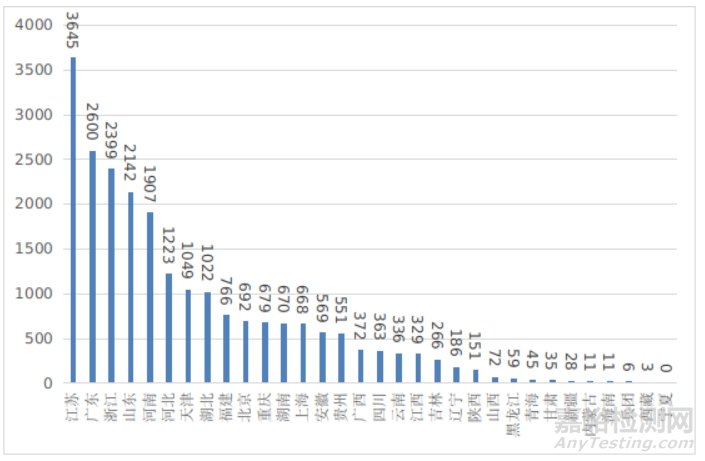
图21 各省第一类医疗器械备案排位图
(三)登记事项变更/变更备案情况
2024年,国家药监局依职责共办理进口第二、三类和境内第三类医疗器械变更备案9852项,与2023年相比增加55.1%。
其中,境内第三类医疗器械变更备案7036项,进口第二类、三类医疗器械变更备案2816项。
各省级药品监管部门依职责共办理境内第二类医疗器械变更备案19347项,与2023年相比增加24.2%。
(四)医疗器械临床试验机构备案情况
自2018年1月1日《医疗器械临床试验机构条件和备案管理办法》颁布实施以来,全国共计1498个机构完成了医疗器械临床试验机构备案工作,2024年新增备案机构158个,比2023年增加11.8%。
其中广东、江苏、山东、浙江、河南临床试验机构备案数量居全国前五名。全国医疗器械临床试验机构分布情况见图22。
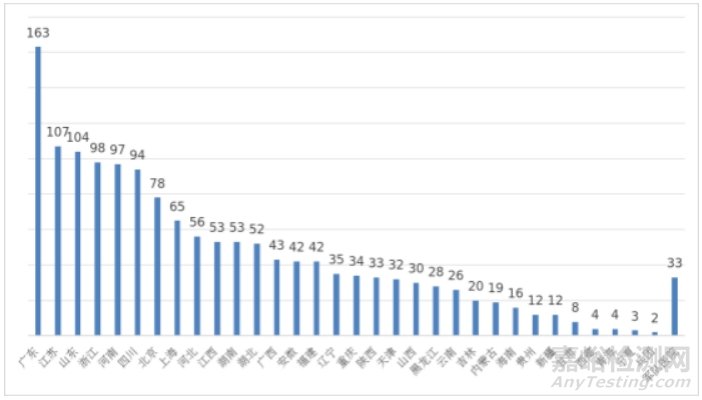
图22 全国医疗器械临床试验机构备案数量
注:本报告的数据统计自2024年1月1日至2024年12月31日。
附件1.doc
2024年获批创新医疗器械产品名单
|
序号 |
产品名称 |
注册人 |
注册证号 |
|---|---|---|---|
|
1 |
胃转流支架系统 |
杭州糖吉医疗科技有限公司 |
国械注准20243130104 |
|
2 |
IFI44L基因甲基化检测试剂盒(PCR-熔解曲线法) |
深圳市赛尔生物技术有限公司 |
国械注准20243400284 |
|
3 |
颅内动脉瘤CT造影图像辅助检测软件 |
杭州深睿博联科技有限公司 |
国械注准20243210396 |
|
4 |
支气管镜操作控制系统用无源器械和附件 |
IntuitiveSurgical, Inc. |
国械注进20242080127 |
|
5 |
一次性使用心脏脉冲电场消融导管 |
杭州德诺电生理医疗科技有限公司 |
国械注准20243010461 |
|
6 |
支气管导航光纤定位导管导引器 |
IntuitiveSurgical, Inc. |
国械注进20242010154 |
|
7 |
支气管导航光纤定位导管 |
IntuitiveSurgical, Inc. |
国械注进20243010156 |
|
8 |
支气管导航可视化探头 |
IntuitiveSurgical, Inc. |
国械注进20242060153 |
|
9 |
支气管导航操作控制系统 |
IntuitiveSurgical, Inc. |
国械注进20243010155 |
|
10 |
组合血糖仪 |
江苏精策医疗科技有限公司 |
国械注准20243070662 |
|
11 |
寡糖链检测试剂盒(荧光毛细管电泳法) |
江苏先思达生物科技有限公司 |
国械注准20243400663 |
|
12 |
体外心室辅助设备 |
心擎医疗(苏州)股份有限公司 |
国械注准20243100773 |
|
13 |
体外心室辅助泵头及管路 |
心擎医疗(苏州)股份有限公司 |
国械注准20243100774 |
|
14 |
一次性使用多极肾动脉射频消融导管 |
Medtronic, Inc. |
国械注进20243010242 |
|
15 |
肾动脉射频消融仪 |
Medtronic, Inc. |
国械注进20243010243 |
|
16 |
双通道可充电植入式脑深部电刺激脉冲发生器套件 |
北京品驰医疗设备有限公司 |
国械注准20243120979 |
|
17 |
双通道植入式脑深部电刺激脉冲发生器套件 |
北京品驰医疗设备有限公司 |
国械注准20243120980 |
|
18 |
植入式脑深部电刺激电极导线套件 |
北京品驰医疗设备有限公司 |
国械注准20243120981 |
|
19 |
植入式脑深部电刺激延伸导线套件 |
北京品驰医疗设备有限公司 |
国械注准20243120982 |
|
20 |
肺动脉取栓支架系统 |
上海腾复医疗科技有限公司 |
国械注准20243031010 |
|
21 |
经颈静脉肝内穿刺器械 |
北京爱霖医疗科技有限公司 |
国械注准20243031052 |
|
22 |
一次性使用射频房间隔穿刺针 |
杭州诺生医疗科技有限公司 |
国械注准20243011095 |
|
23 |
眼底病变眼底图像辅助诊断软件 |
北京致远慧图科技有限公司 |
国械注准20243211109 |
|
24 |
支气管导航操作控制系统用针 |
IntuitiveSurgical, Inc. |
国械注准20242020316 |
|
25 |
冷冻消融仪 |
上海安钛克医疗科技有限公司 |
国械注准20243011210 |
|
26 |
一次性使用心脏脉冲电场消融导管 |
FARAPULSE,Inc. |
国械注进20243010355 |
|
27 |
心脏脉冲电场消融系统 |
FARAPULSE,Inc. |
国械注进20243090354 |
|
28 |
髂静脉支架系统 |
杭州唯强医疗科技有限公司 |
国械注准20243131244 |
|
29 |
一次性使用心腔内超声成像导管 |
深圳市赛禾医疗技术有限公司 |
国械注准20243061274 |
|
30 |
便携式超声诊断仪 |
深圳市赛禾医疗技术有限公司 |
国械注准20243061271 |
|
31 |
一次性使用可调弯导管鞘 |
FARAPULSE,Inc. |
国械注进20243030396 |
|
32 |
生物可吸收雷帕霉素洗脱冠脉支架系统 |
上海微创医疗器械(集团)有限公司 |
国械注准20243131356 |
|
33 |
肾动脉射频消融仪 |
苏州信迈医疗器械有限公司 |
国械注准20243011383 |
|
34 |
一次性使用肾动脉射频消融导管 |
苏州信迈医疗器械有限公司 |
国械注准20243011384 |
|
35 |
肾动脉射频消融仪 |
上海魅丽纬叶医疗科技有限公司 |
国械注准20243011387 |
|
36 |
一次性使用网状肾动脉射频消融导管 |
上海魅丽纬叶医疗科技有限公司 |
国械注准20243011385 |
|
37 |
球囊型冷冻消融导管 |
上海安钛克医疗科技有限公司 |
国械注准20243011414 |
|
38 |
经导管主动脉瓣膜系统 |
上海纽脉医疗科技股份有限公司 |
国械注准20243131459 |
|
39 |
静脉支架系统 |
上海蓝脉医疗科技有限公司 |
国械注准20243131528 |
|
40 |
经导管主动脉瓣系统 |
北京佰仁医疗科技股份有限公司 |
国械注准20243131529 |
|
41 |
血管斑块旋切控制装置 |
Boston Scientific Corporation |
国械注进20243010448 |
|
42 |
一次性使用外周血管斑块旋切导管 |
Boston Scientific Corporation |
国械注进20243010449 |
|
43 |
乙型肝炎病毒表面抗原(HBsAg)检测试剂盒 |
富士瑞必欧株式会社 |
国械注进20243400480 |
|
44 |
导航定位微波消融系统 |
真健康(珠海)医疗科技有限公司 |
国械注准20243011651 |
|
45 |
心脏脉冲电场消融仪 |
美敦力公司 |
国械注进20243010482 |
|
46 |
一次性使用心脏脉冲电场消融导管 |
美敦力公司 |
国械注进20243010487 |
|
47 |
颅内动脉瘤CT血管造影图像辅助检测软件 |
上海联影智能医疗科技有限公司 |
国械注准20243211923 |
|
48 |
膝关节假体系统 |
雅博尼西医疗科技(苏州)有限公司 |
国械注准20243132151 |
|
49 |
颅内动脉瘤栓塞辅助支架 |
上海心玮医疗科技股份有限公司 |
国械注准20243132152 |
|
50 |
脑外科手术计划软件 |
华科精准(北京)医疗科技有限公司 |
国械注准20243212209 |
|
51 |
植入式脑深部神经刺激电极 |
Boston Scientific Neuromodulation Corporation |
国械注进20243120580 |
|
52 |
氧化锆陶瓷股骨头 |
北京安颂科技有限公司 |
国械注准20243132300 |
|
53 |
植入式心脏起搏电极导线 |
创领心律管理医疗器械(上海)有限公司 |
国械注准20243122320 |
|
54 |
超声诊断系统 |
深圳迈瑞生物医疗电子股份有限公司 |
国械注准20243062383 |
|
55 |
一次性使用陡脉冲消融针 |
杭州睿笛生物科技有限公司 |
国械注准20243092384 |
|
56 |
陡脉冲治疗设备 |
杭州睿笛生物科技有限公司 |
国械注准20243092385 |
|
57 |
质子治疗系统 |
瓦里安医疗系统粒子治疗有限公司 |
国械注进20243050647 |
|
58 |
质子治疗系统 |
迈胜医疗系统公司 |
国械注进20243050656 |
|
59 |
心脏脉冲电场消融仪 |
上海宏桐实业有限公司 |
国械注准20243012477 |
|
60 |
人工血管 |
上海畅迪医疗科技有限公司 |
国械注准20243132518 |
|
61 |
主动脉覆膜支架破膜系统 |
先健科技(深圳有限公司) |
国械注准20243032519 |
|
62 |
肠息肉电子下消化道内窥镜图像辅助检测软件 |
长沙慧维智能医疗科技有限公司 |
国械注准20243212606 |
|
63 |
旋磨介入治疗仪 |
上海微创旋律医疗科技有限公司 |
国械注准20243012607 |
|
64 |
一次性使用冠脉旋磨导管 |
上海微创旋律医疗科技有限公司 |
国械注准20243012608 |
|
65 |
一次性使用磁电定位压力监测脉冲电场消融导管 |
湖南埃普特医疗器械有限公司 |
国械注准20243012609 |
附件2.doc
2024年获批优先医疗器械产品名单
|
序号 |
产品名称 |
注册人 |
注册证号 |
|
1 |
人外泌体CA125、HE4、C5a检测试剂盒(化学发光法) |
上海思路迪生物医学科技有限公司 |
国械注准20243400138 |
|
2 |
人类ONECUT2/VIM基因甲基化检测试剂盒(荧光PCR法) |
广州市基准医疗有限责任公司 |
国械注准20243400221 |
|
3 |
一次性使用血液灌流器 |
天津优纳斯生物科技有限公司 |
国械注准20243100617 |
|
4 |
视网膜下注射套件 |
MedOne Surgical, Inc. |
国械注进20242160228 |
|
5 |
结核分枝杆菌利福平及异烟肼耐药突变检测试剂盒(荧光PCR熔解曲线法) |
厦门致善生物科技股份有限公司 |
国械注准20243400763 |
|
6 |
乙型肝炎病毒核糖核酸(HBV RNA)检测试剂盒(PCR-荧光探针法) |
圣湘生物科技股份有限公司 |
国械注准20243401083 |
|
7 |
PD-L1(JS311)抗体试剂(免疫组织化学法) |
迈杰转化医学研究(苏州)有限公司 |
国械注准20243402135 |
|
8 |
碳离子治疗系统 |
兰州科近泰基新技术有限责任公司 |
国械注准20243052382 |

来源:国家药监局


