您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-05-06 22:27
摘要
目的:研究医疗器械标准及其在注册审评中的作用,为我国医疗器械注册审评审批体制改革提供参考。方法:采用文献研究的方法,从医疗器械标准的法律地位和依据入手,探讨医疗器械标准与安全有效及注册审评的关系。结论:医疗器械标准是指由国家药品监督管理局依据职责组织制修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一技术要求。医疗器械产品符合标准不代表安全有效,医疗器械注册是对产品安全有效的符合性评价,评价原则是医疗器械安全有效基本要求,评价内容是以注册申报资料为主的安全有效研究及其结果。医疗器械标准是产品设计输入和验证的依据和方法,其对医疗器械注册审评的作用是间接的,主要通过医疗器械安全有效基本要求清单、产品技术要求和研究资料三个主要方面发挥作用。笔者建议,要厘清医疗器械标准的定位,系统加强标准在监管中的作用,同时构建我国的标准认可机制。
2017 年,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,旨在进一步优化管理系统与产业结构,提升产业竞争力,更好适应公众临床需要。医疗器械注册管理制度改革,应首先厘清基本概念,然后明确概念之间的关系,并在此基础上建立科学制度,从而推动系统的改革、实现预期目的 [1]。其中,研究医疗器械标准的概念、厘清医疗器械标准与安全有效及注册审评的关系,对我国推动医疗器械审评审批体制改革具有重要意义。
医疗器械标准的定义
医疗器械标准属于标准。标准是经济社会活动的技术依据,在国家治理体系和治理能力现代 化 建 设 中, 发 挥 着 基 础 性、引领性、战略性作用 [2]。我国GB/T 20000.1-2014《 标 准化工作指南 第 1 部分 :标准化和相关活动的通用术语》中的5.3 条,给出了标准的定义 [3]:标准是“通过标准化活动,按照规定的程序经协商一致制定,为各种活动或其结果提供规则、指南或特性,供共同使用和重复使用的文件。”
根据 2017 版的《医疗器械标准管理办法》[4],医疗器械标准,是指由国家药品监督管理部门依据职责组织制修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求。
医疗器械标准的法规依据和作用
我国对医疗器械的管理起源于 20 世纪 90 年代,当时的主要依据是国家标准和企业标准,暂无专门法规和具体安全性有效性要求。2000 年,国务院实施第一版《医疗器械监督管理条例》,将企业标准更名为“注册产品标准”,并将其作为药监部门的管理依据之一,继续强化医疗器械标准的地位。2014 年《医疗器械监督管理条例》[5] 及其配套规章修订,医疗器械标准的地位得到了进一步加强。
1 医疗器械标准是对产品的基本要求
《医疗器械监督管理条例》第六条规定,“医疗器械产品应当符合医疗器械强制性国家标准 ;尚无强制性国家标准的,应当符合医疗器械强制性行业标准”。
2 医疗器械标准是上市后产品生产的依据之一
《医疗器械监督管理条例》第二十四条规定,“医疗器械生产企业应当严格按照经注册或者备案的产品技术要求组织生产,保证出厂的医疗器械符合强制性标准以及经注册或者备案的产品技术要求”;第五十二条规定,“医疗器械生产企业发现其生产的医疗器械不符合强制性标准、经注册或者备案的产品技术要求或者存在其他缺陷的,应当立即停止生产”。
3 符合医疗器械强制性标准是产品延续注册的要求
《医疗器械监督管理条例》第十五条规定,“有下列情形之一的,不予延续注册 :医疗器械强制性标准已经修订,申请延续注册的医疗器械不能达到新要求的”。
4 医疗器械标准是对说明书和标签的要求
《医疗器械监督管理条例》第四十二条规定,“进口的医疗器械应当有中文说明书、中文标签。说明书、标签应当符合本条例规定以及相关强制性标准的要求”。
5 医疗器械标准是政府部门上市后监管的工具
《医疗器械监督管理条例》规定,“食品药品监督管理部门应当对医疗器械的注册、备案、生产、经营、使用活动加强监督检查,并对下列事项进行重点监督检查”,其中“生产、经营、使用不符合强制性标准或者不符合经注册或者备案的产品技术要求的医疗器械的”。
综上所述,医疗器械标准是对医疗器械产品的基本要求,覆盖医疗器械产品的全生命周期,包括注册、延续注册、生产和使用;医疗器械标准也可以说是行业共识,是制造商与监管部门共同遵循的评价指标,是医疗器械监督管理的重要手段和依据。
医疗器械标准与产品安全有效的关系
医疗器械注册管理是监管的重要组成,为了发挥标准在注册管理的作用,必须对标准和产品安全有效的关系有正确的认识。医疗器械标准是对产品的基本要求,一种常见的误解长期存在 :符合标准的产品即是安全有效的产品。
医疗器械没有绝对安全,所谓的安全是相对风险而言。正如《医疗器械 风险管理对医疗器械的应用》(YY/T 0316-2016)[6]所定义的,安全性是免除于不可接受的风险。风险按照对象划分,通常包括对患者的风险、使用者的风险、环境的风险等 ;按照危害类型划分,通常包括能量危害、生物学危害、化学危害、操作危害、信息危害。从单个标准的角度是对单一或部分风险的控制,例如 GB 9706.1-2007[7] 是对电气安全风险的控制,YY 0505-2012[8] 是对电磁兼容风险的控制,GB/T 16886.1-2011[9] 是对生物相容性风险的控制。因此,符合某项标准仅仅是某一类的风险得到控制,体现的是局部的相对安全性。医疗器械的复杂性、多样性决定不可能单纯靠多个标准的组合应用来完全控制其风险,需要结合产品具体特点运用标准,充分考虑标准未能涵盖和控制的风险。可见,符合标准是保障安全性的必要条件而非充分条件。
有效性的定义是“能够实现预期目的”,医疗器械产品的预期目的是解决医疗问题,因此,有效性的评价是从医学受益的角度。例如,用于治疗严重慢性症状的一款植入式器械,有 75% 的机率可以显著改善患者的生活质量和活动能力 ;这是该产品的有效性[10]。正如《医疗器械风险管理对医疗器械的应用》[6] 所述,“风险是损害发生概率与该损害严重程度的结合,而损害是对人体健康的实际伤害”;“风险不用于临床决策”,临床决策是受益和风险的权衡,由此可见安全性或者风险是不能用来衡量产品有效性的,即一个产品是安全的,不能从任何方面证明其是有效的。标准中的性能指标仅是产品设计开发的参考,是否能保证有效性还需要结合临床数据或其他研究资料进行验证或确认。
综上所述,符合标准只是证明规定的某些性能或安全要求得到了满足,但不一定能证明医疗器械预期用途得到满足,产品受益大于风险,因此不一定是安全有效。
医疗器械标准在注册审评中的作用
《医疗器械注册管理办法》[11]明确,医疗器械注册是药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。从这个定义可以看出,医疗器械注册的核心任务是评价安全、有效,评价的内容是医疗器械安全性、有效性研究及其结果。
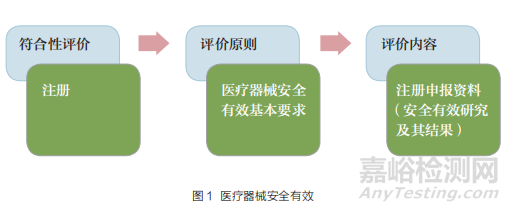
有了评价目标和评价内容后,重要的是评价标准。医疗器械安全有效基本要求(以下简称基本要求)是以医疗器械为对象,对其在整个生命周期内必须达到的安全与性能做出明确规定 [12]。该基本要求在国际上已经得到多年的 广 泛 应 用,IMDRF 各 成 员 国为贯彻基本要求,在注册申报资料中都设置了相关的内容 [13,14]。中国作为 IMDRF 成员国,也在2014 年法规制修订时正式将基本要求列入法规。《医疗器械注册管理办法》第十一条规定“申请人或者备案人申请注册或者办理备案,应当遵循医疗器械安全有效基本要求,保证研制过程规范,所有数据真实、完整和可溯源”,评价要求如图 1 所示。
医疗器械注册是对产品安全有效的符合性评价,评价原则是医疗器械安全有效基本要求,评价内容是以注册申报资料为主的安全有效研究及其结果。安全有效就是符合医疗器械安全有效的基本要求 [15]。
由于医疗器械标准不在安全有效基本要求中,因此标准在医疗器械注册审评中的作用是间接的,主要通过医疗器械安全有效基本要求清单、产品技术要求和研究资料三个主要方面发挥作用。
1 标准是证明符合基本要求的方法依据
医疗器械安全有效基本要求清单在注册申报资料的一部分,其中明确,“通常可采取下列方法证明符合基本要求 [16] :(1)符合已发布的医疗器械部门规章、规范性文件。(2)符合医疗器 械相关国家标准、行业标准、国际标准”。
2 标准是产品技术要求编制的依据
医疗器械产品技术要求的核心内容是性能指标和检验方法。《医疗器械产品技术要求编写指导原则》[17] 中明确,“产品技术要求中性能指标的制定应参考相关国家标准 / 行业标准并结合具体产品的设计特性、预期用途和质量控制水平且不应低于产品适用的强制性国家标准 / 行业标准”,“检验方法的制定应与相应的性能指标相适应。应优先考虑采用公认的或已颁布的标准检验方法”。
3 标准是研究开展的依据
研究资料包括七个部分的研究,其中性能研究、生物相容性研究、灭菌确认等研究都可以依据标准开展 [18]。例如,生物相容性研究依据 GB/T 16886.1-2011。
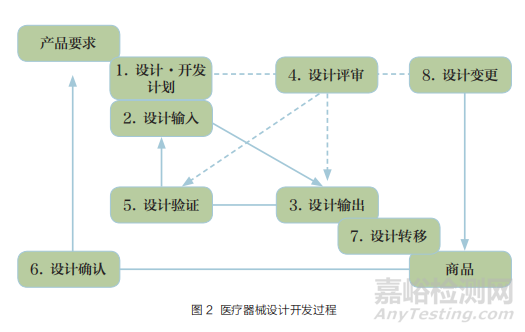
除了上述研究外,风险管理也是依据标准 YY/T 0316-2016开展。虽然对应注册申报资料的不同部分,但这些资料其实都是安全有效的研究及其结果的总结,属于产品设计开发的范围 [19]。根据《医疗器械生产质量管理规范》[20],“设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。对设计和开发输入应当进行评审并得到批准,保持相关记录”“企业应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录”。设计开发过程如图 2 所示。
综上,标准中的要求是产品设计输入之一,试验方法可作为设计验证方法的设定依据,标准为设计开发提供可用的依据和方法。
结论与展望
综上所述,医疗器械标准,是指由国家药品监管部门依据职责组织制修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一技术要求。医疗器械标准覆盖医疗器械产品的全生命周期,包括注册、延续注册、生产和使用;医疗器械标准也是国家监督管理的重要手段和依据。
医疗器械产品符合标准不代表安全有效,医疗器械注册是对产品安全有效的符合性评价,评价原则是医疗器械安全有效基本要求,评价内容是以注册申报资料为主的安全有效研究及其结果,安全有效是符合医疗器械注册上市的基本要求。
医疗器械标准在医疗器械注册审评中的作用是间接的,主要通过医疗器械安全有效基本要求清单、产品技术要求和研究资料三个主要方面发挥作用 ;标准中的要求是产品设计输入之一,试验方法可作为设计验证方法的设定依据,标准为产品设的计开发提供可用的依据和方法。
为加强医疗器械标准在医疗器械注册管理中的作用,建议从厘清定位、加强标准与安全有效的关联,以及构建我国的标准认可机制三个方面进行完善。
第一,要厘清定位,使行业正确理解和使用标准。标准中的要求是产品设计输入之一,试验方法可作为设计验证方法的设定依据,标准为设计开发提供可用的依据和方法。
第二,要加强标准与安全有效的关联,从系统的角度加强标准和指导原则、法规的关联 [21],形成互补,共同推动医疗器械科学监管。例如,IMDRF 的指南《提升为监管所用的标准质量》[22] 中明确,医疗器械标准应与安全有效基本要求对应,以附录形式说明对应关系。
第三,构建我国的认可标准管理机制。1997 年,《FDA 现代化法案》修正了《医疗器械修正案》第 514(c)条,将原来的“由机构自行决定颁布强制性标准”,修改为“正式认可全部或部分标准”[23]。其中,“认可”是指对医疗器械制造商声明符合性时 FDA认定适用的标准 [24]。
随着我国医疗器械行业蓬勃发展,随着我国标准化工作改革推进,未来将有很多团体标准或由第三方制定的标准涌现,建议参考美国的管理思路,建立医疗器械团体标准认可机制,与社会资源共同推动健康中国和行业发展。

来源:AnyTesting


