您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-04-20 10:57
1、导读
三类植入医疗器械是最高风险的一类器械,在器械设计开发时,植入后组织反应是必须考虑的生物学风险之一。
局部组织反应与全身系统性作用有着显著区别,很难通过毒理学进行评价。需在动物体内进行植入试验,评价植入体组织反应。方法通常参照ISO 10993.6进行,将器械所使用的材料,制备成合适大小的块状、片状、棒状或圆柱体,植入预期接触类似的动物组织中,最后取出植入部位的组织,固定、脱水、切片、显微镜下分析组织病理学反应。
这种试验方法,实际上存在许多不足之处
1)体积较大的器械通常需要特殊制备成试验样品,才能植入到动物体内,样品的表面和几何形状往往不代表最终器械;
2)特殊制备的样品,很难去论证与最终器械经过了相同工艺处理;
3)植入部位与器械最终使用部位不同,很难进行评价;
4)器械由多个部件组成,需要对每种材料单独进行植入试验,无法一次性评价多种材料。
有没有什么办法优化这些问题呢?笔者认为,原位植入(在预期使用部位植入医疗器械),最后按ISO 10993.6标准进行组织病理学分析,评价器械植入周围组织反应,这可能是解决问题的有效手段之一
2、原位植入实验
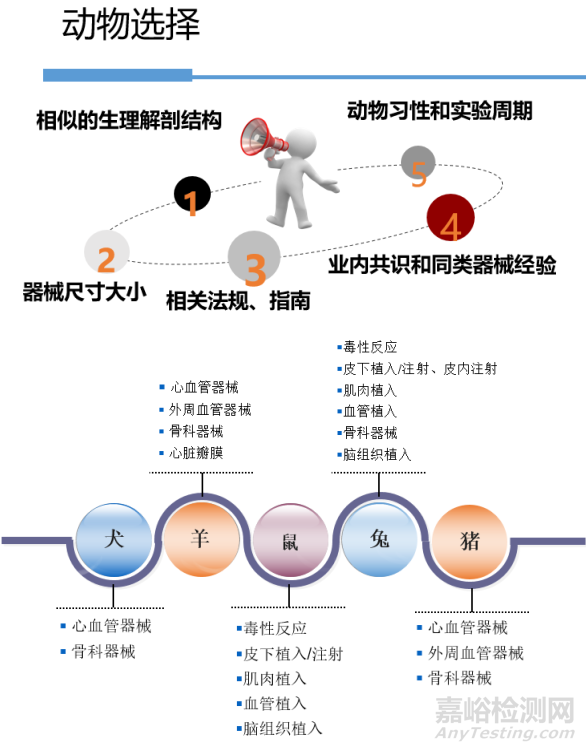
2.1 实验动物选择
医疗器械原位植入实验的动物模型选择,主要考虑以下几个方面:
1)与人体的生理解剖结构差异;
2)器械尺寸大小;
3)相关法规、指南要求;
4)业内共识和同类器械经验;
5)动物习性和实验周期。
图1 原位植入实验动物选择考虑因素
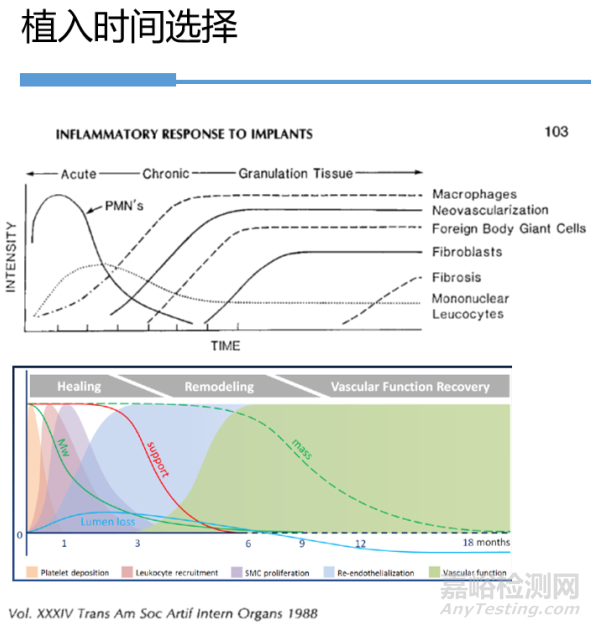
2.2 植入时间选择
植入时间应由可能的临床暴露时间决定,或持续到或超过达到生物反应的稳定状态。选择的时间点应加以说明。
1.对于非降解和非吸收性材料,一般评定从1周至4周的短期反应和超过12周试验的长期反应。
2.对可降解材料的评价试验需要达到或超过吸收终点。
图2 原位植入时间选择因素
2.3 观察指标
原位植入不但可评价器械组织反应,还可以收集许多可用性和有效性指标:包括不限于:1)器械可操作性能;2)器械毒性指标(临床病理、组织病理);3)影像学指标(CT、OCT超声、X光等);4)组织病理学(SEM、TEM、组织病理切片)
3、实例(心脏冠脉支架植入)
3.1 冠脉支架植入
冠脉支架植入实验,采用国际上公认的小型猪冠脉过度扩张导致再狭窄模型,这是因为健康猪冠脉支架扩张损伤后的修复与人病变血管扩张损伤导致的血管修复相类似,冠状动脉走行、管腔直径、心肌舒缩对支架的力学作用等也与人类相似,支架植入后新生内膜成分主要为平滑肌细胞,也与人类相近,实验猪作为实验动物,因其与人有相似的解剖结构。
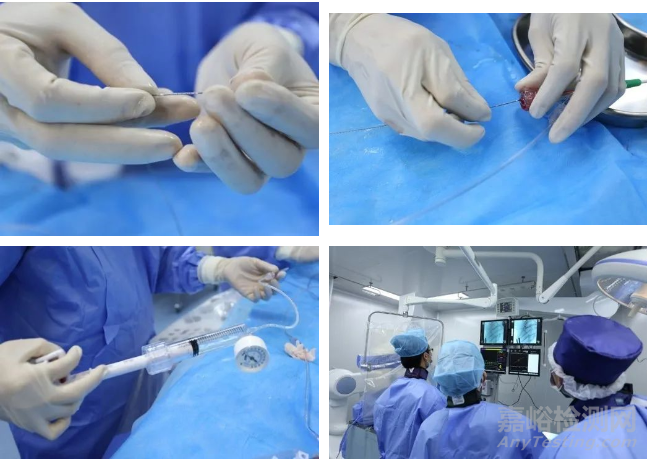
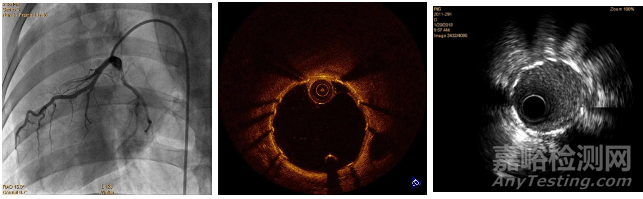
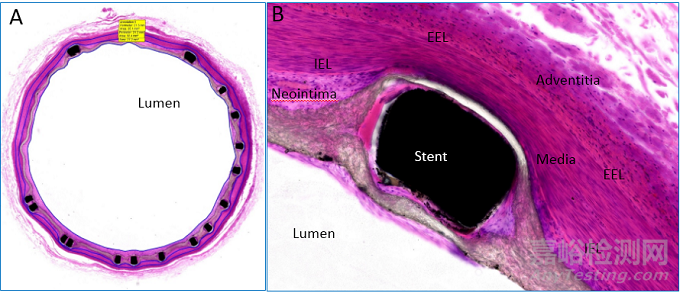
心脏冠脉支架植入需要特定导管室,以及影像设备,试验开始时从股动脉穿刺,插入穿刺鞘和导丝,经鞘管沿导丝将导管送至冠状动脉开口位置,造影观察冠状动脉情况,沿导丝送入球囊支架系统扩开支架,经OCT探查管腔情况,完成植入。
植入过程如图3所示,植入后造影图如图4所示。
图3 冠脉支架植入过程
图4 植入影像学检查
3.2 组织病理评价指标
根据标准ISO10993-6要求,用于组织学评价的计分系统评价受影响部位的冠脉血管,采用定量或半定量评价。记录植入物方位、切片数量和组织块的几何形状。
应评定和记录的生物学反应指标包括:
01
纤维化/纤维囊腔(层厚,以微米表示)和炎症程度;
02
由组织形态学改变而确定的变性;
03
取决于与材料/组织界面的距离有关的炎性细胞类型,即嗜中性粒细胞、淋巴细胞、浆细胞、嗜酸性粒细胞、巨噬细胞和多核细胞的数量和分布
04
坏死的存在、程度和类型;
05
其他组织改变,如血管形成、脂肪浸润、肉芽肿、钙化和骨形成;
06
材料参数,如破裂、和/或碎片存在、可降解材料残留物的形状和位置;
07
对于多孔和可降解植入材料,长入组织的定性和定量;
对于可降解/可吸收性材料,在试验中期或接近完全降解水平阶段,检查的组织样品内存在一些降解植入物的残留材料,此外,在评价组织修复至正常结构时,应评价植入部位的有代表性区域,可采用标记或模板的方式指示
3.3炎性反应评价系统
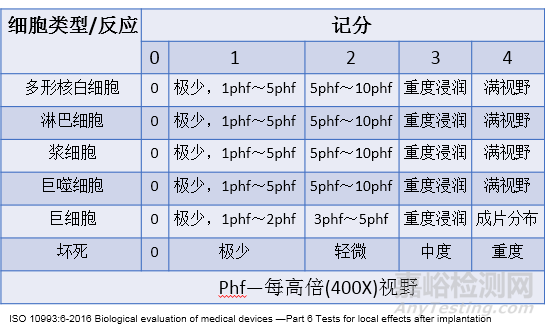
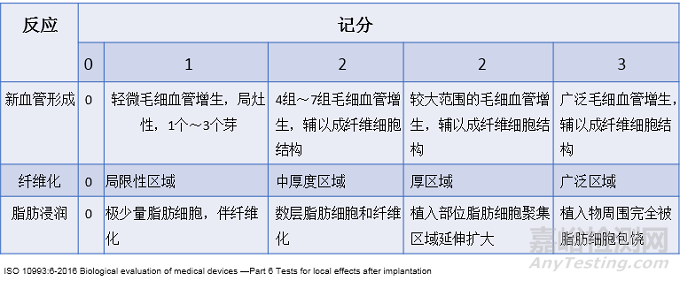
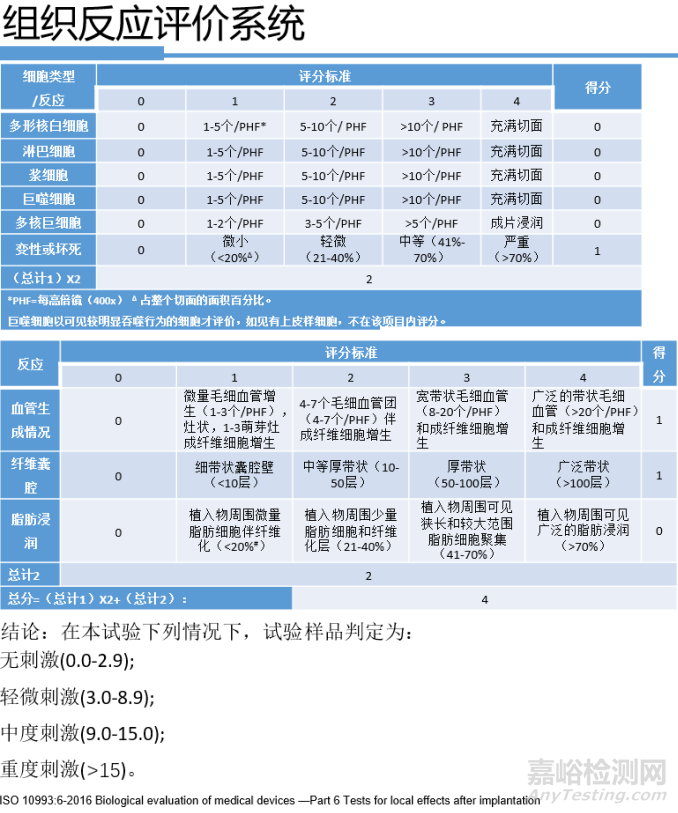
标准10993-6:2016给出了植入试验组织病理学反应的评价系统,根据该评价系统可对植入后的组织病理进行半定量评价,通过与对照样品病理评分比较,确定测试器械/材料对组织的刺激等级。如表1、表2、表3所示。
表1 组织学评价系统举例—细胞类型/反应
表2 组织学评价系统举例—反应
表3 组织反应评价系统
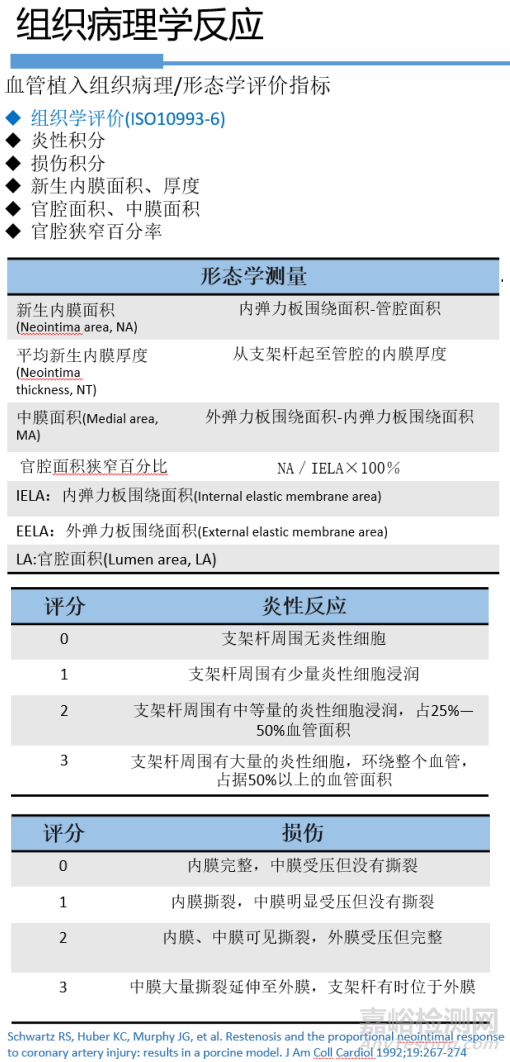
3.4 组织病理学反应
支架植入除了参考标准ISO10993-6给出的组织病理评价方法外,还可以考虑其他评价指标,例如,管腔面积丢失率、血管壁损伤积分、新手内膜面积等,用以综合评价器械安全有效性。各项指标见下表4:
表4 组织病理学反应
4、原位植入实验要求
1. 需要非常专业的团队执行手术。
2. 器械多种多样,对实验方案和术者要求较高。

来源:张贵领先


