您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-15 08:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
FDA批准辉瑞培非格司亭上市。FDA批准辉瑞开发的Neulasta(安进品牌药)生物类似药Nyvepria(培非格司亭)上市,具体适应症为:正在接受与发热性中性粒细胞减少症临床显著发生率相关的骨髓抑制性抗癌药(如化疗)治疗的非髓系恶性肿瘤患者,减少感染的发生率,表现为发热性中性粒细胞减少。FDA批准Nyvepria是基于对一个综合数据包的审查,以及证明Nyvepria与其参考产品Neulasta具有高度相似的全部证据。目前,Nyvepria也正在接受欧洲药品管理局(EMA)的审查。这是FDA批准的第四款Neulasta生物类似药。
国内药讯
1.海正盐酸多奈哌齐口崩片首家通过一致性评价。海正药业4类仿制药盐酸多奈哌齐口崩片(5mg、10mg)获国家药监局批准上市,成为该品种该剂型首家通过一致性评价的产品。盐酸多奈哌齐口崩片适用于轻中度阿尔茨海默病症的治疗,原研产品由日本卫材药业研发,2011年获批进口中国。IMS数据显示,2019年盐酸多奈哌齐口崩片全球销售额为27,593.89万美元,其中中国销售额为77.89万美元。目前国内获批生产盐酸多奈哌齐口崩片的企业有辅仁药业、金日制药(中国)、升和药业。
2.长效 EPO「达依泊汀α」国内即将获批。协和发酵麒麟株式会社的达依泊汀α在国内的上市申请处于「在审批」,预计即将获批上市,用于治疗慢性肾功能衰竭血透患者贫血。达依泊汀α(Darbepoetin alfa)是安进于2001年9月获FDA批准上市的一种长效重组人促红细胞生成素(rhEPO),商品名为Arnesp,2019年销售额为17.3亿美元。目前,国内已上市的EPO药物主要以短效为主,获批的生产厂家有三生制药、深圳赛保尔、科兴生物等;尚无国产长效rhEPO产品获批上市。
3.正大天晴PD-L1启动晚期肾细胞癌III期临床。正大天晴登记启动抗PD-L1单抗TQB2450联合安罗替尼对比舒尼替尼治疗晚期肾细胞癌随机、开放、阳性药物平行对照、多中心III期临床试验。该研究拟入组418例患者,评价这一组合用于一线治疗的有效性和安全性,评价TQB2450注射液的免疫原性,以及探索生物标志物与疗效的相关性。该试验的主要终点指标为无进展生存时间(PFS)。
4.安进/百济神州合作双抗AMG 160获批临床。安进和百济神州联合申报的HLE-BiTE免疫疗法AMG 160 获CDE临床试验默示许可,拟开发用于治疗成人转移性去势抵抗性前列腺癌。今年1月份,百济神州已与安进达成全球肿瘤战略合作,将合作开发20款在研的安进抗肿瘤管线药物,AMG160属于合作产品之一。目前该在研药于全球范围处于I期临床开发阶段,开发适应症为前列腺癌。
5.绿叶伊立替康氟脲苷脂质体临床申请获受理。绿叶制药创新产品盐酸伊立替康氟脲苷脂质体注射液(LY01616)的临床试验申请获CDE受理。伊立替康联合氟尿嘧啶类的联合化疗是晚期结直肠癌的首选方案之一,LY01616是一种同时包载伊立替康和氟脲苷的复方脂质体的创新药物,拟用于晚期结直肠癌的治疗。据悉,目前全球暂无该产品上市,这也是国内首个申报临床的复方脂质体药物。
6.中国首款盐酸曲恩汀上市申请拟纳入优先审评。佛山德芮可制药按5.2类申请进口的盐酸曲恩汀胶囊获CDE纳入拟优先审评公示名单。盐酸曲恩汀(trientine)是一款铜离子络合剂,原研产品由默克开发,1986年在美国获批上市,用于治疗威尔逊病(又称肝豆状核变性),可供不能耐受青霉胺的患者选用。值得一提的是,这是目前为止唯一一款在中国申报临床和提交上市申请的盐酸曲恩汀胶囊。
7.礼进生物与默沙东达成临床研发合作。礼进生物与默沙东旗下子公司达成临床试验合作协议,以评估礼进生物第二代4-1BB(CD137)激动剂LVGN6051与默沙东的PD-1抑制剂可瑞达(Keytruda,帕博利珠单抗)治疗多种恶性肿瘤中的效果,包括肺癌、黑色素瘤、MSI-H或DMMR-H高的胃肠道癌和淋巴瘤。CD137是免疫杀伤T细胞的刺激信号,LVGN6051结合CD137和FcγRIIB并有效激动CD137信号通路,增强癌症免疫治疗效果。该产品在2019年开始Ⅰ期临床试验,预计2021年进入Ⅱ期临床。
国际药讯
1.FDA批准Viela Bio公司CD19单抗上市。Viela Bio公司CD19单抗Uplizna(inebilizumab)获FDA批准上市,用于治疗AQP4阳性的成人视神经脊髓炎谱系疾病(NMOSD)患者。在一项关键性临床N-Momentum中,与安慰剂相比,inebilizumab显著降低AQP4阳性患者NMOSD发作的风险,两组治疗6个月后疾病没有复发的患者比例为89%和58%,到达主要终点指标;inebilizumab在降低NMOSD相关的住院率等关键次要终点上也显示出统计学意义的改善;研究中,inebilizumab安全性和耐受性良好。豪森药业拥有该药的中国权益。
2.迈兰/Biocon甘精胰岛素注射液获FDA批准。迈兰和Biocon Biologics宣布,FDA已批准小瓶装和预填充注射笔形式的Semglee (甘精胰岛素注射液)的新药申请,用于控制2型糖尿病(T2DM)成人以及1型糖尿病(T1DM)成人和儿童患者的高血糖。在一项包含INSTRIDE 1和INSTRIDE 2两项试验的INSTRIDE研究中,这2项试验分别在T1DM和T2DM患者中评估Semglee相比Lantus(赛诺菲)治疗的非劣效性,主要终点为24周后糖化血红蛋白的基线变化。对T1DM和T2DM患者的安全性、有效性和免疫原性数据表明,Semglee和Lantus没有差异。
3.Moderna新冠疫苗确定Ⅲ期临床试验方案。Moderna公司宣布已与FDA达成共识,其mRNA新冠疫苗将在Ⅲ期临床中选用100μg作为疫苗接种剂量。这项随机双盲,含安慰剂对照的Ⅲ期研究拟入组约3万名参与者,将与美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)合作开展。主要终点为预防有症状的COVID-19疾病;关键性次要终点包括预防严重的COVID-19疾病(定义为需要住院治疗)和预防新冠病毒感染引起的COVID-19。Ⅲ期研究预计7月开始给药。目前,该疫苗的Ⅱ期临床已完成包含300名18-54岁健康成年人的志愿者队列入组,以及包含50名55岁以上老年人的“试点”队列入组。
4.再生元抗病毒抗体鸡尾酒疗法COVID-19项目临床启动。再生元开发的拟用于预防和治疗COVID-19的研究性双抗体鸡尾酒疗法REGN-COV2(REGN10933+REGN10987)启动首个临床试验。该研究将由4个队列组成:住院的COVID-19患者、非住院有症状的COVID-19患者、高危暴露人群中的未感染人群(如医护人员)和密切暴露于COVID-19患者的未感染人群(如患者的室友)。前两个队列Ⅰ/Ⅱ/Ⅲ期研究旨在评估REGN-COV2治疗住院和非住院COVID-19患者的安全性和有效性。关于这两款抗体的临床前研究近日将在《科学》杂志上发布。
5.诺和诺德收购Corvidia Therapeutics。诺和诺德拟收购专注于开发变革性心脏和肾脏疾病疗法的Corvidia Therapeutics公司。该公司主要候选药物--全人源化IL-6单抗ziltivekimab拟开发用于降低慢性肾病(CKD)患者的主要心血管不良事件(MACE)风险,这些患者同时患有动脉粥样硬化性心血管疾病和炎症。Ziltivekimab目前正在Ⅱb期临床中评估治疗C反应蛋白(CRP)水平高的Ⅲ-Ⅴ期慢性肾病患者的潜力。根据协议,诺和诺德将支付给Corvidia公司7.25亿美元前期付款,总计付款最终可能达到21亿美元。
医药热点
1.北京公布36例新增病例具体情况。6月14日上午,在北京市新冠肺炎疫情防控工作新闻发布会上,北京市疾控中心副主任庞星火介绍了6月13日新增确诊病例相关情况。6月13日0时至24时,北京市新增新冠肺炎确诊病例36例,阳性检测者1例。确诊病例中男性15例,女性21例;现住丰台区30例,大兴区4例,房山区1例,西城区1例;在新发地市场工作者27例,曾直接或间接暴露于新发地市场者9例;通过主动就医发现11例,疫情溯源筛查主动发现25例。
2.所有发热门诊患者须检测核酸。国务院应对新型冠状病毒肺炎疫情联防联控机制综合组印发《关于发挥医疗机构哨点作用做好常态化疫情防控工作的通知》。《通知》强调,所有到发热门诊就诊的患者,必须扫“健康码”,并进行核酸检测。要充分发挥医疗机构在疫情防控中的哨点作用,实现及时发现、快速处置、精准管控、有效救治,做好常态化疫情防控工作。
3.德意法荷成立新冠疫苗联盟。据欧联网综合报道,英国牛津大学主管新冠病毒疫苗测试的贝尔(John Bell)教授表示,牛津研制的疫苗最早将于2020年9月底上市,并有望于圣诞节期间在英国全面推出。此外,当地时间6月13日,德国、意大利、法国和荷兰四国已经成立了一个新冠病毒疫苗联盟,并已与阿斯利康签署预购协议,预定了3亿支牛津研发的该款疫苗。在牛津这款疫苗研制成功后,整个欧洲可能能够得到4亿支疫苗。
股市资讯
【现代制药】公司收到国家药监局核准签发的克拉霉素片《药品补充申请批件》,批准该药品通过一致性评价。
【华海药业】截至6月12日,公司股东翁震宇通过集中竞价交易方式减持935.77万股,减持比例为0.64%。
【迦南科技】公司全资孙公司天津莱米特于近日收到天津市科学技术局、天津市财政局等联合颁发的《高新技术企业证书》。
审评动向
1. CDE最新受理情况(06月14日)
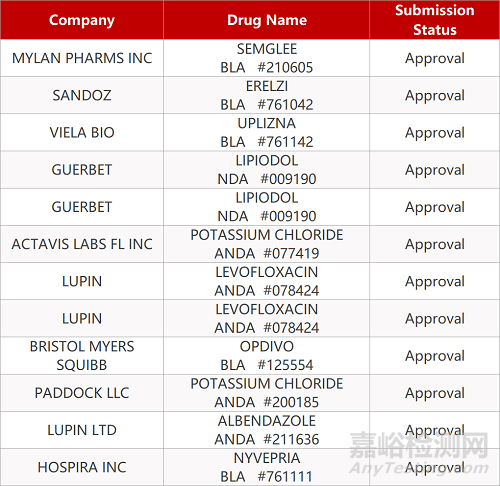
2. FDA最新获批情况(北美06月11日)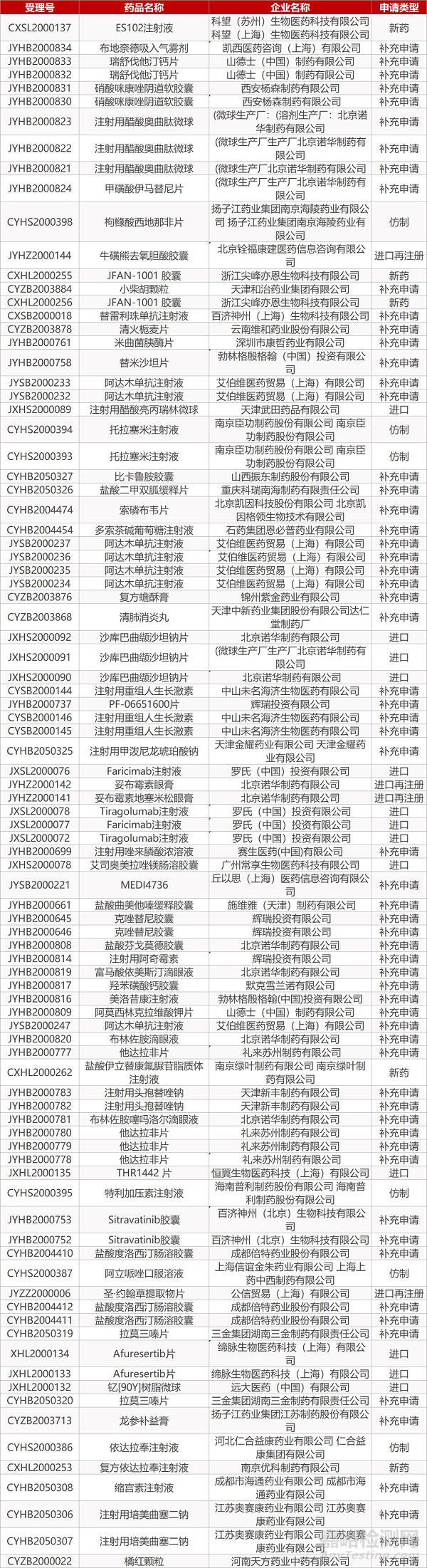
- The End -

来源:药研发


