您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-08 10:37
近日,国家药监局公布北京汇福康医疗技术股份有限公司的创新医疗器械周围神经套接管的审评报告,我们一起来了解一下周围神经套接管在研发阶段做了哪些实验。
产品中文名称:周围神经套接管
产品管理类别:第三类
申请人名称:北京汇福康医疗技术股份有限公司
技术审评概述
一、产品概述
(一)产品结构及组成
该产品由壳聚糖材料经乙酰化制成,呈无色或淡黄色半透明管状,表面覆盖甘油水溶液以防止产品干燥,使用前需清洗。产品经辐照灭菌,一次性使用。货架有效期20个月。
(二)产品适用范围
该产品用于非病理性神经损伤的上肢正中神经、尺神经、桡神经离断伤(神经缺损长度不大于2cm),进行神经断端的端对端无张力套接缝合修复。
(三)型号/规格
型号:SJG-01
规格:S1210、S1310、S1410、S1510、S1610
(四)工作原理
通过外科手术将周围神经套接管与神经两断端进行缝合(套管内神经断端之间留出2mm 的小间隙),暂时固定支持损伤神经的两断端,并为两断端神经提供一个相对封闭而不受其他组织干扰的空间,定向的管道空间有助于引导神经元的轴突轴向生长,同时利用周围神经选择性再生的特点有效促进神经的准确对接,减少外生和神经瘤的发生。壳聚糖材料可降解,并最终被人体吸收。
二、临床前研究概述
(一)产品性能研究
产品技术要求研究项目如表1所示:


产品性能研究提交了产品技术要求中各项目指标及试验方法的确定依据及有关支持性资料,针对产品技术要求中的各项性能均开展了相应的性能验证。
同时,性能研究项目还包括:原材料红外研究、产品乙酰化程度研究、乙酰化工艺验证、产品微观结构研究、使用前清洗方法研究等,结果表明产品符合设计输入要求。
(二)生物相容性评价研究
该产品与人体接触方式为植入,接触部位为肌肉、神经和组织液,接触时间为持久接触,在人体内降解吸收。申请人依据现行法规要求及GB/T16886系列标准进行了生物相容性评价,提交了生物学评价报告。其中,针对以下项目进行试验并提交试验报告:细胞毒性、遗传毒性、皮肤致敏、 皮内反应、急性全身毒性、亚慢性毒性、植入试验、体内降解、神经毒性评估、热原试验。生物相容性评价支持产品生物学风险可接受。
(三)生物安全性研究
该产品中含有经乙酰化的壳聚糖成分,申请人依据《动物源性医疗器械产品注册申报资料指导原则》提供生物安全性研究资料。包括:对动物源性材料来源控制的支持性资料,对病毒去除/灭活进行了研究,生物安全性研究资料显示产品在病毒、其他病原体传染方面的风险可接受;提供了免疫原性风险评价资料,开展了相应的免疫毒理研究,并选择蛋白质残留量作为免疫原性质量控制的项目并列入产品技术要求,综合上述内容及临床试验中安全性指标的结果,认为产品免疫原风险可以接受。
(四)灭菌工艺研究
产品经Co60辐照灭菌。申请人提供了灭菌过程确认报告,证明无菌保证水平可达10-6。灭菌后产品性能符合要求。
(五)产品有效期和包装研究
该产品货架有效期20个月。申请人提供了货架有效期和包装研究资料,验证实验为加速老化和实时老化验证,包括产品稳定性、运输稳定性验证、包装完整性验证。
(六)动物实验研究
动物实验研究的目的是评价产品在周围神经损伤模型中采用小间隙套接修复的方法以达到促进神经再生和恢复神经功能为治疗目的的安全性和有效性。实验利用健康的恒河猴和SD大鼠建立周围神经损伤动物模型,分别于术后不同时间点评价移植物安全性(包括大体观察、组织学分析等)、有效性(包括运 动神经传导速度、坐骨神经功能指数(SFI)、锇酸染色观察再 生的髓鞘组织、远端靶器官的肌肉湿重和肌纤维质量等),实验结果表明产品可达到预期设计要求。
三、临床评价概述
该产品以临床试验方式进行临床评价。临床试验目的为评价产品在修复周围神经损伤过程中的安全性和有效性。临床试验采用多中心、随机对照、开放的试验设计方法。试验组施行 周围神经套接管套接缝合,对照组应用神经外膜缝合方法修复上肢周围神经离断伤。主要评价指标为术后 6 个月包含感觉功能、运动功能和植物神经功能评价的周围神经功能综合优良率。次要评价指标包括手术时间、疼痛缓解情况、运动功能检查、 BMRC 感觉评价、植物神经功能检查、交感神经功能检查。安全性评价指标包括不良反应、副作用、不良事件。
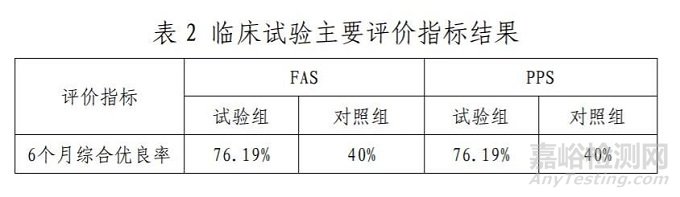
该临床试验在 3 家临床机构开展,实际入组 64 例患者(试验组 33 例/对照组 31 例)患者,全分析集(FAS)、符合方案集 (PPS)和安全集(SS)包含患者64 例。主要评价指标结果如表 2 所示,试验组优于对照组。单根神经缝合时间、疼痛缓解情况、交感神经功能检查两组间有统计学差异,其他次要评价指标两组间无统计学差异。试验组未发现不良事件。
该产品的临床应用中通过对周围神经断端的套接来达到修复周围神经离断伤的目的。临床上可以实现对非病理性神经损 伤的上肢正中神经、尺神经、桡神经离断伤(神经缺损长度不大于 2cm)神经断端的端对端无张力套接缝合修复,但可能有潜在的并发症,如过敏反应、局部血肿、感染以及神经套接管的断裂、失效等。临床试验结果,经综合评价,在目前认知水平上,认为该产品为患者带来的临床受益大于风险。
四、产品受益风险判定
参照《YY/T0316-2016 医疗器械风险管理对医疗器械的应用》,对该产品进行风险分析。对目前已知及可预测风险采取了风险控制措施,经综合评价,在目前认知水平上,认为该产品上市带来的获益/受益大于风险。为保证用械安全,需在说明书中提示以下信息:
(一)警示及注意事项
1、警示及提示
(1)本产品是一次性使用无菌产品,不得重复使用。
(2)内包装破损、超过有效期限禁止使用。
2、注意事项
(1)本产品应由有资质的专业医生使用,须掌握显微外科操作。
(2)本产品的使用应该在充分游离神经断端的基础之上,神经断端可以直接外膜缝合,周围神经套接管与神经缝合后无张力,术后与应用其他神经修复方法的辅助措施一样,需要辅助使用跨临近关节的外固定。
(3)周围神经套接管缝合后断端的间隙应该保持在2mm范围内。
(4)产品表面覆盖保护液以防止产品干燥,植入前需要用无菌注射用水或无菌生理盐水进行浸泡和洗涤,具体方案为每根周围神经套接管浸泡于500ml无菌注射用水中30分钟,之后在 50ml无菌注射用水中震荡洗涤3次(每次震荡时间5~10秒)。
(5)使用中根据患者具体实际情况,由医生选择判断使用的手术缝合线型号。
(二)禁忌症
1、心、肺、肝、肾功能严重失代偿者。
2、各种慢性消耗性疾病造成恶液质,不能耐受手术。
3、病理性周围神经损伤。
4、周围神经附近存在局部急、慢性感染。
5、长段神经缺损。
6、婴幼儿、儿童、青少年、孕妇以及术后1年内计划怀孕的患者。
7、甲壳质过敏者。
综合评价意见
该申报产品属按照《创新医疗器械特别审批程序(试行)》审批项目,编号 201700189。申请人的注册申报资料符合现行要求。依据《医疗器械监督管理条例》(国务院令第 680 号)、《医疗器械 注册管理办法》(原国家食品药品监督管理总局令 2014 年第 4 号)等相关医疗器械法规与配套规章, 经系统评价后,建议准予注册。

来源:CMDE


