您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-18 01:56
1.法规依据
根据《医疗器械监督管理条例》(国务院令第650号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅰ类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在CFDA进行备案。
第Ⅱ类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,境内生产企业需要在所在地省(直辖市)药监局进行注册,境外医疗器械生产企业需要委托境内代理人在CFDA进行注册。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在CFDA进行注册。
2.注册条件
申报主体
拟从事医疗器械生产且在境内销售的境内生产企业
拟出口医疗器械到中国的境外生产企业
拟在中国大陆销售医疗器械产品的港澳台地区的生产企业
注:境外及港澳台生产企业必须委托在中国境内设立的分支机构或指定的代理人进行注册(备案)申报。
医疗器械注册(备案)类型
中国医疗器械按管理类别分为Ⅰ类、Ⅱ类、Ⅲ类医疗器械,具体产品管理类别的归属,以国家食品药品监督管理部门发布的《医疗器械分类规则》、《医疗器械分类目录》以及不定时发布的分类界定通知为主要依据。
按照医疗器械的类别、注册不同阶段等情况,医疗器械的注册可以分为首次注册、注册变更、延续注册三个类型。
|
产品类别 |
注册类型 |
适用范围 |
|
非体外诊断试剂 |
备案 |
无论境外如何管理,境内按第Ⅰ类医疗器械管理的产品 |
|
首次注册 |
(1)境外按医疗器械管理的已上市的第Ⅱ、Ⅲ类医疗器械产品首次进入中国市场 |
|
|
注册变更 |
登记事项变更: |
|
|
延续注册 |
(1)到期重新注册 |
|
|
体外诊断试剂 |
备案 |
无论境外如何管理,境内按第Ⅰ类医疗器械管理的产品 |
|
首次注册 |
(1)第Ⅱ、Ⅲ类体外诊断试剂产品首次进入中国市场; |
|
|
注册变更 |
登记事项变更: |
|
|
延续注册 |
在医疗器械注册证书有效期届满后仍需继续生产、销售的产品应在注册证书有效期届满6个月前、且有效期届满前12个月内提出申请。 |
3.注册申请及审批流程
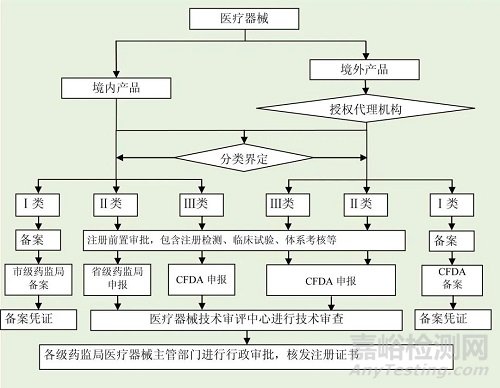
4.医疗器械注册服务流程
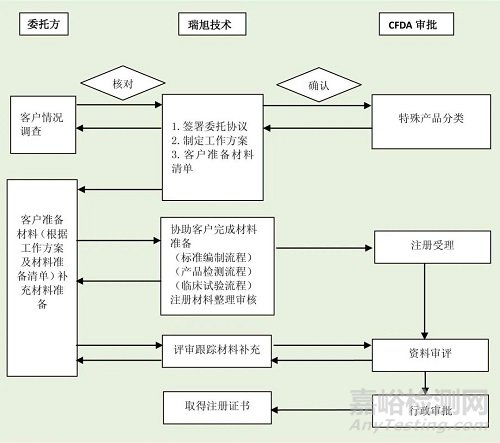

来源:Internet


