今日头条
维眸小分子眼科新药获批临床。维眸生物1类化药VVN461滴眼液获国家药监局临床试验默示许可,拟用于治疗非感染性眼前节葡萄膜炎患者。VVN461是一种强效的小分子免疫调节剂,高活性抑制多个细胞因子通路,从而减轻和缓解眼部的炎症反应。在体外全血实验中,该产品显示出在低纳摩尔浓度时抑制IL-2引发的炎症反应的潜力。
国内药讯
1.恒瑞PD-1单抗新适应症获批上市。恒瑞医药PD-1注射用卡瑞利珠单抗第九项适应症上市申请获国家药监局批准,联合甲磺酸阿帕替尼用于不可切除或转移性肝细胞癌患者的一线治疗。去年5月,卡瑞利珠单抗联合VEGFR2抑制剂甲磺酸阿帕替尼一线治疗晚期肝细胞癌的国际III期临床(SHR-1210-Ⅲ-310)达到主要研究终点,与索拉非尼相比,卡瑞利珠单抗联合阿帕替尼可显著延长患者的无进展生存期(PFS)以及总生存期(OS)。
2.泰它西普获批重症肌无力III期临床。荣昌生物BLyS/APRIL双靶点融合蛋白泰它西普(RC18,泰爱®)获FDA批准可开展用于治疗重症肌无力(MG)患者的III期临床试验。值得一提的是,FDA同时也授予泰它西普用于MG的快速通道资格。在国内开展的Ⅱ期临床数据显示,泰它西普160 mg组患者第24周QMG评分平均降低7.7分,240 mg组的QMG评分平均降低9.6分,具统计学意义。
3.和誉CSF-1R抑制剂获突破性疗法认定。和誉医药创新CSF-1R抑制剂pimicotinib(ABSK021)获FDA授予突破性疗法认定,用于治疗不可手术的腱鞘巨细胞瘤。在治疗晚期腱鞘巨细胞瘤的Ⅰb期试验中,pimicotinib的初步总缓解率(ORR)达到68.0%,并具有良好的安全性和PK/PD特性。CDE已于去年7月将其纳入突破性治疗品种。
4.泽璟JAK抑制剂启动重症新冠临床。泽璟制药自主研发的新型JAK抑制剂杰克替尼(jaktinib)在clinicaltrials.gov官网上登记启动一项治疗重症新冠的II期临床试验。该项研究旨在评估杰克替尼在现有接受最佳治疗方案的重症新冠患者中的疗效和安全性。研究预计开始时间是2023年1月,完成时间是2024年6月,主要终点是接受治疗28天后出现死亡或呼吸衰竭的患者比例。
5.捷思英达Aurora A抑制剂启动Ⅰ期临床。捷思英达小分子创新药Aurora A抑制剂VIC-1911在美国启动一项Ⅰ期临床,拟评估单药治疗及联合Sotorasib治疗KRAS G12C突变型非小细胞肺癌(NSCLC)的安全性与有效性。该项研究由耶鲁大学癌症中心医学博士Sarah Goldberg担任首席研究员 (PI) 和研究主席。此前已完成的Ⅰa期临床数据显示,VIC-1911和奥希替尼等EGFR抑制剂联用,有望改善EGFR突变的NSCLC的一线治疗效果。
6.杭州厚无自体TIL疗法获批临床。杭州厚无生物与广东天科雅联合开发的全新一代自体TIL细胞治疗产品HV-101注射液获国家药监局临床许可,适应症为晚期复发或者转移性实体瘤。TIL疗法是指从肿瘤组织中分离浸润的T淋巴细胞、经体外培养和大量扩增后回输到病人体内的细胞疗法。除天科雅、厚无生物外,国内还有多家企业布局TIL疗法,包括沙砾生物、君赛生物、西比曼生物等。
7.信立泰自免病1类新药获批临床。信立泰1类化药SAL0119片获国家药监局临床许可,适应症为活动性强直性脊柱炎(AS)及中重度活动性类风湿关节炎(RA)。SAL0119是一款口服小分子免疫抑制剂,具有独特的不同于JAK类的作用机制和广谱的细胞因子抑制作用。临床前研究数据已显示出SAL0119具有良好的有效性和安全性,有望为AS、RA患者提供新的用药选择。
国际药讯
1.度普利尤单抗在欧盟获批新适应症。欧盟委员会(EC)批准再生元与赛诺菲开发的IL-4/IL-13抑制剂度普利尤单抗(dupilumab,Dupixent)新适应症,用于治疗12岁及以上青少年和成人嗜酸性粒细胞性食管炎(EoE)。在临床试验中,与安慰剂相比,Dupixent治疗24周后显著改善嗜酸性食管炎的症状,包括吞咽能力和食管中的嗜酸性粒细胞数量。Dupixent也是FDA批准的首款治疗嗜酸性食管炎的疗法。
2.抗抑郁新疗法Ⅱa期试验成功。Small Pharma公司旗下N, N-二甲基色胺(DMT)药物SPL026在治疗抑郁症(MDD)患者的Ⅱa期临床达到主要终点。与安慰剂相比,SPL026联合支持性疗法使患者两周后的抑郁症状出现具有统计学意义的缓解,MADRS评分降低7.4分(P=0.02)。接受过至少一剂SPL026治疗和支持性治疗的受试者的抑郁症状的持续改善长达12周。药物总体耐受性良好。
3.IL-36R单抗用于GPP的IIb期临床成功。勃林格殷格翰IL-36R单抗spesolimab(佩索利单抗)用于预防泛发性脓疱型银屑病(GPP)急性发作的IIb期研究EFFISAYIL 2达到主要终点及关键次要终点。研究结果显示,spesolimab用于维持治疗可预防患者GPP发作长达48周;而且其安全性与先前报道结果一致。去年9月,FDA首次批准spesolimab用于治疗GPP的急性发作。
4.莫德纳RSV疫苗获突破性疗法认定。Moderna公司编码RSV融合前F糖蛋白的mRNA疫苗mRNA-1345获FDA授予突破性疗法认定(BTD),用以预防60岁以上成人罹患呼吸道合胞病毒相关下呼吸道疾病(RSV-LRTD)。在Ⅲ期临床ConquerRSV中,与安慰剂组相比,mRNA-1345组出现两种或两种以上RSV-LRTD症状的病例数目更少(9例vs55例),疫苗预防效力达到83.7%(95.88% CI:66.1%,92.2%;p<0.0001)。此前,FDA已授予mRNA-1345快速通道资格。
5.安进双抗多肽偶联药启动减重Ⅱ期临床。安进潜在“first-in-class”的GIPR/GLP-1R双抗多肽偶联药物AMG 133在clinicaltrials.gov上登记启动一项Ⅱ期临床。I期临床数据显示,与安慰剂相比,AMG 133每四周给药一次可使患者体重显著下降;其中低剂量140mg组和高剂量420mg组患者体重分别减少7.2%和14.5%,而安慰剂组受试者体重增加1.49%。临床中,大多数治疗紧急不良事件是轻微且短暂的。
6.Sana公司CD19靶向CAR-T获批临床。Sana Biotechnology基于干细胞来源的同种异体CAR-T疗法SC291获FDA临床许可,拟开发用于治疗各种B细胞恶性肿瘤患者。SC291是该公司专有的体外细胞工程平台(低免疫原性技术)开发的一款靶向CD19的CAR- T疗法。临床前研究证明,经低免疫原性编辑技术修饰的非人灵长类动物 iPSC,在移植到同种异体受者体内后可以存活。
医药热点
1.四川强化养老机构等级评定。四川省新修订的《四川省养老机构等级评定管理办法》将自2月1日起实施。根据《办法》,申请等级评定的养老机构分为一般养老机构和农村敬老院两种类型。一般养老机构主要包含公办老年社会福利院和民办养老机构(含公建民营养老机构),评定等级采用五个等级,从低到高分别授予一星、二星、三星、四星、五星;农村敬老院评定等级采用三个等级,从低到高分别授予一星、二星、三星。
2.北京:非急诊挂号全面预约。近日,北京市卫健委印发《北京市医疗机构门诊预约诊疗服务管理规范》。《规范》明确,北京市二级以上医院实行非急诊全面预约挂号,医疗机构开展预约诊疗服务时,应为包括老年人在内的特殊就医人群提供一定比例的现场号源;鼓励有条件的医疗机构在晚间、周末、节假日开设知名专家门诊和特需门诊。
3.中国基因编辑等7项技术将被禁止/限制出口。为加强技术进出口管理,中国商务部会同科技部等部门将对《中国禁止出口限制出口技术目录》进行修订。本次修订拟删除技术条目32项,修改36项,新增7项。修订后《目录》共139项,其中,禁止出口技术24项,限制出口技术115项。主要涉及互联网与信息、光伏与新能源、自动驾驶、生物医药等。新增的7项技术分别是:光伏硅片制备技术、激光雷达系统、用于人的细胞克隆和基因编辑技术、CRISPR基因编辑技术、合成生物学技术、农作物杂交优势利用技术、散料装卸输送技术。
评审动态
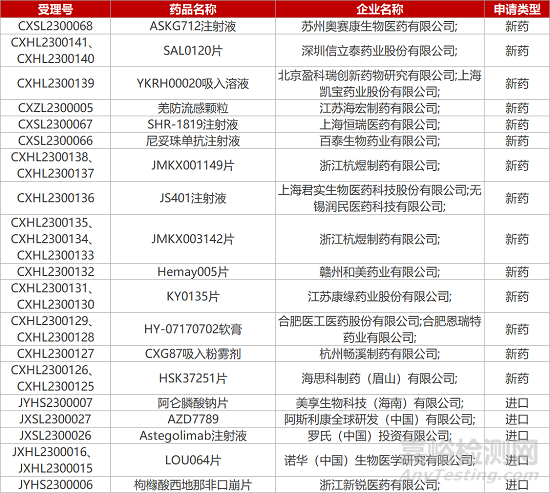
1. CDE新药受理情况(01月31日)
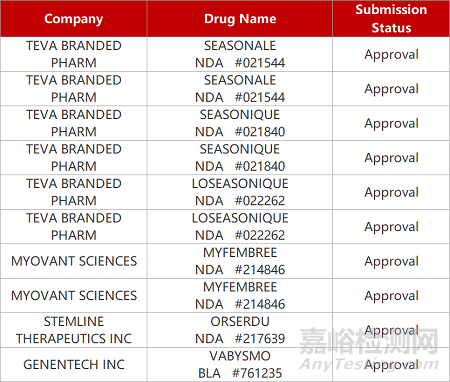
2. FDA新药获批情况(北美01月27日)