随着法规 MDR(2017/745) 的生效,新的标签要求也开始实施。与 MDD指令( 93/42/EEC )相比, MDR的标签需要更多信息。MDR 法规在标签方面引入了两个重要问题:
1. 生产商必须在自己的公司网站上公布标签和说明书
2. 引入了医疗器械唯一标识(UDI)系统
医疗器械标签标识尽管简单,但因为及其重要,也最直观,也是最容易被监管到的错误事项,因此,了解并正常使用符合MDR法规的标签标识,对医疗器械CE认证企业来说非常重要。
一、MDR 附录I中第III章23.2对于产品标签要求进行了规定:
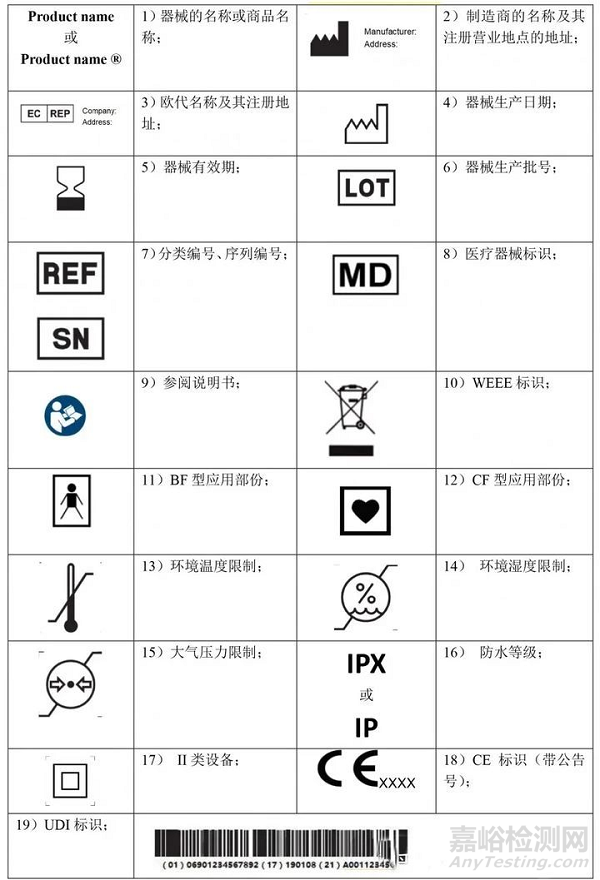
1. 器械的名称或商品名称;
2. 使用者识别器械所必需的详细信息、包装内容以及对于使用者不明显的器械预期用途;
3. 制造商的名称、注册商号商标及其注册营业地点的地址;
4. 授权代表的姓名和注册营业地点地址(若制造商在欧盟以外有其注册营业地点)
5. 若没有指明可安全使用的日期,则指明制造日期。若日期清晰可辨,制造日期可作为批号或序列号的一部分。
6. 指明适用的任何特殊储存和/或处理条件;
7. 若以无菌方式提供器械,还应指示其无菌状态和灭菌方法;
8. 需要立即引起器械使用者和任何其他人的注意、需要采取的警戒或预防措施。
9. 若器械用于一次性使用,则相应指明。制造商的一次性使用指示应在整个欧盟内保持一致;
10. UDI 载体应添加在该器械标签和所有更大包装上;
11. 标签应明显、清晰和不可磨灭地添加在器械或其无菌包装上。考虑到器械性质,无法或不适合将标签添加到器械上时,应将 CE 标识添加在包装上。CE 标识也应加贴在有使用说明和任何销售包装中;
12. 应采用器械上市国(同时也是成员国)指定的欧盟官方语言编写,也可以采用预销往国的当地语言;
13. 标签上所需的信息应在器械本身上提供。若不可行或不适当,则某些或所有信息可显示在各单元的包装上和/或多个器械的包装上。
二、对于无菌产品,其独有的要求也在MDR 附录I中第III章23.3中有所规定:
1. 识别无菌包装的指示
2. 器械处于无菌状态的声明
3. 灭菌方法
4. 设备描述
5. 注明“专用于临床研究”。(如适用)
6. 注明“定制设备”。(如适用)
7. 制造的月份和年份
8. 安全使用或植入设备的期限(至少包含年份和月份)
9. 在使用说明中检查的信息,如果无菌包装在使用前损坏或打开,该怎么办。
三、MDR标签要求会遇到的问题和注意事项
尝试遵守欧盟 MDR 标签要求时可能会遇到两个问题:
1.确保涵盖所有必要的符号和信息
2.标签的大小
由于需要更多的符号和数据,最大的挑战将是如何将它们全部放在标签上。在标签设计过程中,请记住以下几点:
标签和说明的媒介、格式、内容、易读性和位置必须与预期用户的技术知识、经验、教育或培训相匹配
此外,使用说明必须以预期用户易于理解的术语编写,并在适当的情况下补充附图和图表。
标签可以以人类可读的格式提供,并且可以用机器可读的信息来补充。
四、常用器械标识一览
A.常用无源器械标识
B.常用有源器械标识
五、引申知识学习
常用的标识就是这些,但是医疗器械的标识涉及范围很广,无法一一列举,可根据产品专标或其他标准来涉及产品标签。
更多的标识要求可以参考以下标准:
ISO 15223-1:2021 Medical devices — Symbols to be used with information to be supplied by the manufacturer — Part 1: General requirements
ISO 20417 :2021 Medical devices — Information to be supplied by the manufacturer
ISO 7000 :2019 Graphical symbols for use on equipment — Index and synopsis
IEC 60417 :2020 Graphical symbols for use on equipment
IEC TR 60878 :2022 Graphical symbols for electrical equipment in medical practice