据《医疗器械监督管理条例》规定,第Ⅱ、Ⅲ类医疗器械采用产品注册管理方式。
境内第二类医疗器械由省、自治区、直辖市药监局审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。
进口第二类、第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
2023年4月注册备案信息汇总统计:
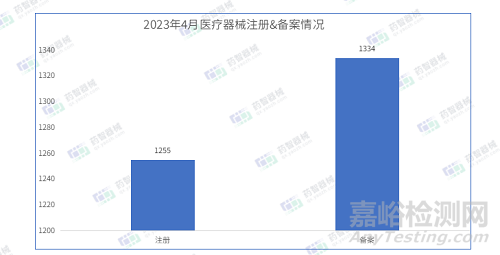
4月注册批准医疗器械数量1255项
4月备案批准医疗器械数量1334项
4月优先审批注册医疗器械产品2项
4月创新审批注册医疗器械产品12项
据最新统计,2023年4月NMPA共批准注册医疗器械1255项,同比减少7.4%,其中优先审批注册2项,创新审批注册12项;审批备案医疗器械数量1334项,同比减少24.7%。
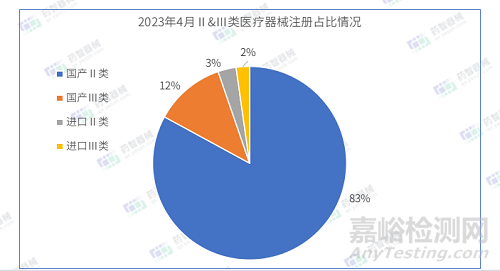
2023年4月,国家药监局共批准注册医疗器械产品1255项。其中,国产第Ⅱ类医疗器械产品1041项,国产第Ⅲ类医疗器械产品148项,进口第Ⅱ类医疗器械产品38项,进口第Ⅲ类医疗器械产品28项,国产占比94.7%。
从产品类别来看,2023年4月注册医疗器械中,体外诊断试剂(363件),注输、护理和防护器械(268件)、及口腔科器械(91件)注册数量排名前三。
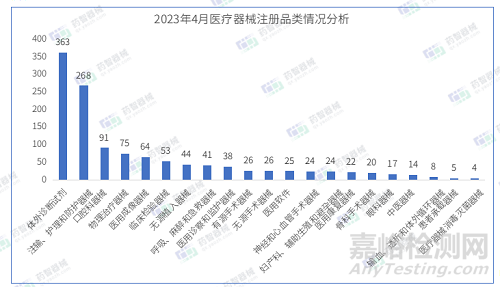
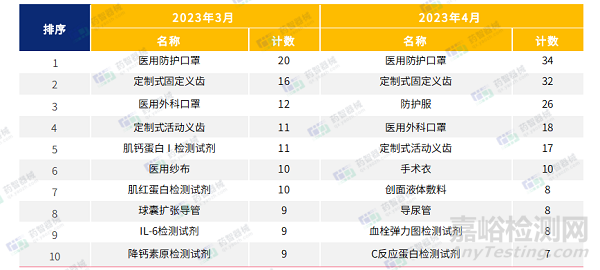
2023年3月-4月,医用口罩等最重要的防护类医疗器械依旧是占据了医疗器械注册产品数量排名第一的位置。此外,4月口腔科器械和创面液体敷料注册数量较前两月明显增加。
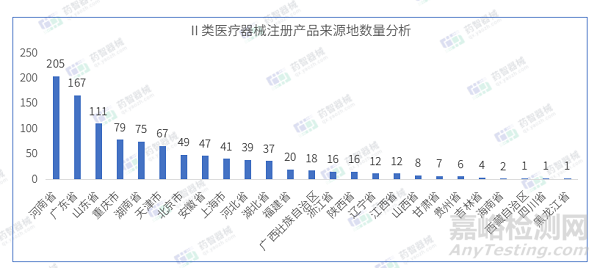
从Ⅱ类医疗器械注册产品来源地分布来看,国内4月共有25个省市(不包括中国港澳台)注册Ⅱ类医疗器械,其中河南省注册医疗器械数量最多,占全部Ⅱ类医疗器械数量的19.6%。
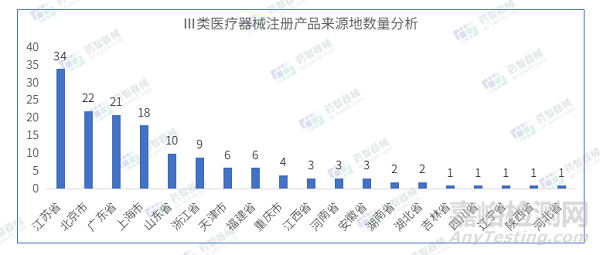
从Ⅲ类医疗器械注册产品来源地分布来看,国内4月共有19个省市(不包括中国港澳台)注册Ⅲ类医疗器械,其中江苏省注册医疗器械数量最多,占全部Ⅲ类医疗器械数量的22.9%。
据《医疗器械监督管理条例》规定,第一类医疗器械采用产品备案管理方式。
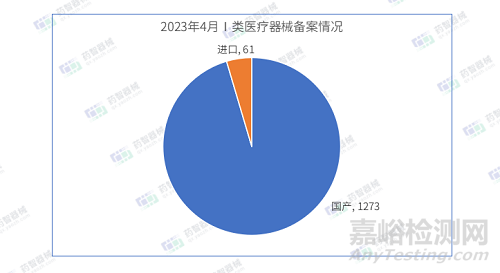
2023年4月国产Ⅰ类医疗器械备案批准数量1273项,同比减少25.4%。同时,进口第一类医疗器械备案批准数量61项,同比减少7.5%。
4月医疗器械创新及优先审批
根据《创新医疗器械特别审批程序(试行)》,我国医疗器械创新审批是为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展的特殊审批通道。
2023年4月,全国创新审批注册产品共计12项,均为国产创新医疗器械产品。
从产品类别来看:12项均为器械产品,无试剂产品。
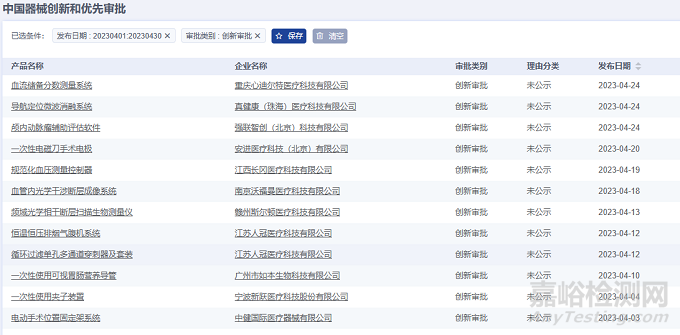
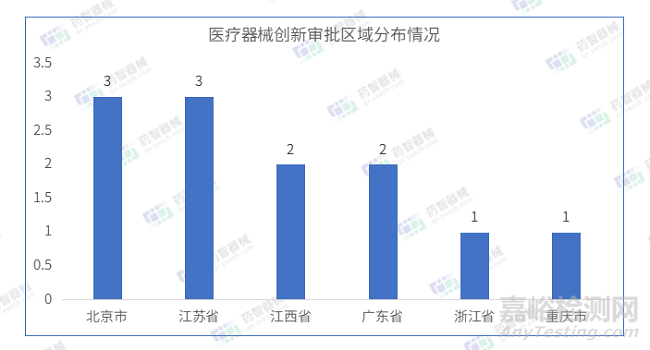
2023年4月共有六个省市注册创新审批医疗器械,其中江苏省和北京市注册数量排名并列第一。
2016年10月25日,国家药监局发布《医疗器械优先审批程序》,于2017年1月1日起施行。根据《医疗器械优先审批程序》,对下列医疗器械实施优先审批:
一是诊断或治疗罕见病、恶性肿瘤且具有明显临床优势的医疗器械,诊断或治疗老年人特有和多发疾病且尚无有效诊断或治疗手段的医疗器械,专用于儿童且具有明显临床优势的医疗器械;
二是列入国家科技重大专项或国家重点研发计划的医疗器械。
此外,将根据各方面情况和意见,组织专家审查后,确定对“其他应当优先审批的医疗器械”予以优先审批。
2023年4月,全国优先审批注册产品共计2项,均为国产医疗器械产品。从产品类别来看:均为器械产品,无试剂产品。
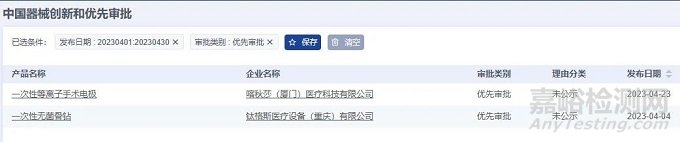
2023年4月共有2个省市注册医疗器械进入优先审批,产品注册数量均为1项。

4月医疗器械注册企业分析
2023年4月国内注册医疗器械企业达675家。排行前十的企业中,排名前三的分别是:郑州蓝跃生物科技股份有限公司、雅博捷锐(重庆)医疗科技有限公司、安阳国医扁鹊健康科技有限公司,排行前十的企业情况如下图所示。
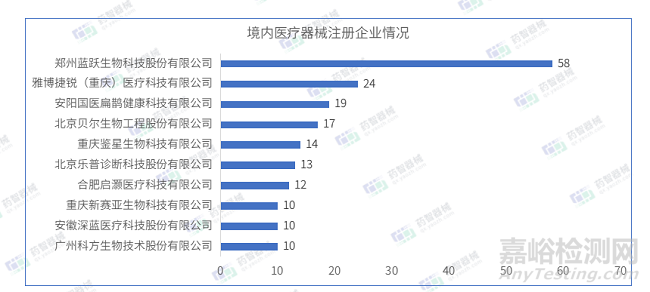
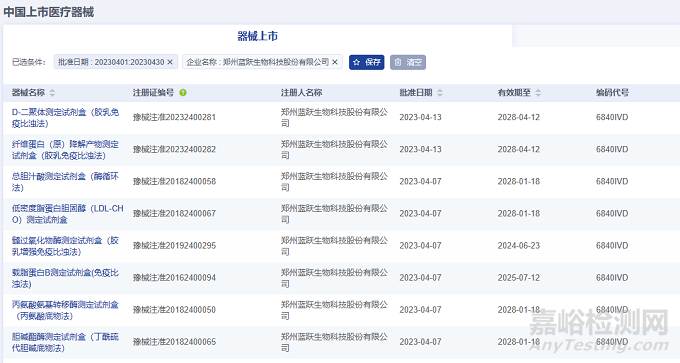
2023年4月,郑州蓝跃生物科技股份有限公司在北京市药监局完成了58项医疗器械,注册产品数量排名第一,均为Ⅱ类IVD诊断试剂产品。
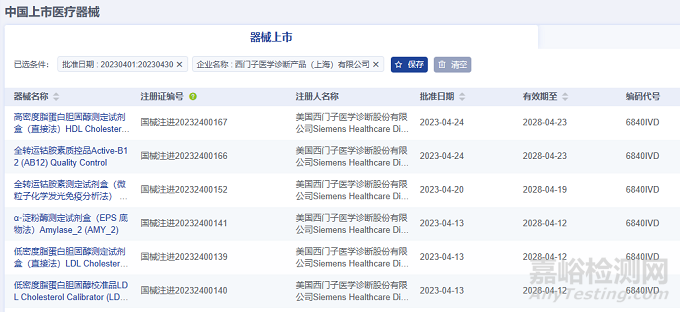
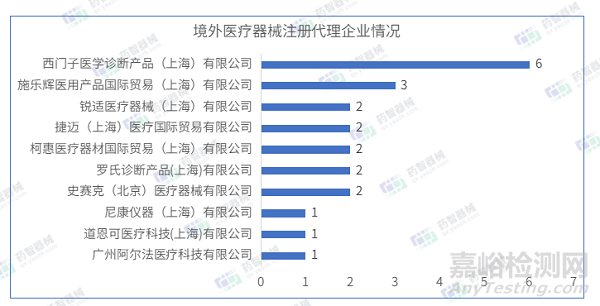
2023年4月进口医疗器械注册代理人企业达54家。排行前十的企业中,排名前三的分别是:西门子医学诊断产品(上海)有限公司、施乐辉医用产品国际贸易(上海)有限公司、锐适医疗器械(上海)有限公司,排行前十的企业情况如下图所示。
西门子医学诊断产品(上海)有限公司代理6项进口医疗器械,均为Ⅱ类体外诊断试剂产品。