近日,急速医疗有限公司研发的“颅内取栓支架”获批上市,下面嘉峪检测网与您一起了解一下颅内取栓支架在临床前研发阶段做了哪些实验。
1、颅内取栓支架的结构及组成
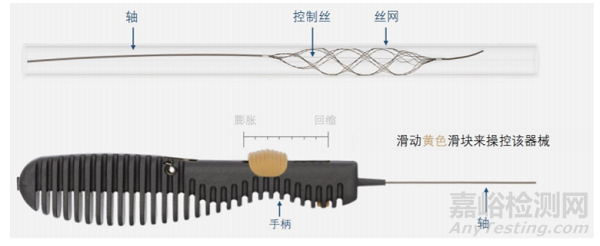
该产品由头端、丝网、推送轴、控制丝和手柄组成,编织丝网的材料为带钽芯镍钛丝,其近端和远端各安装有一个90%铂/10%铱合金的显影标记。产品环氧乙烷灭菌,一次性使用。货架有效期 2.5 年。
2、颅内取栓支架的产品适用范围
该产品预期用于在症状发作 8 小时内移除缺血性脑卒中患者颈内动脉、大脑中动脉 M1 和 M2 段、基底动脉中的血栓,从而恢复血流。不能使用静脉组织型纤溶酶原激活物(IVt-PA)或 IVt-PA 治疗失败的患者是该治疗的人选。
3、颅内取栓支架的工作原理
该产品的目的是局部捕获脑血栓然后将其取出,重建血流。产品结构示意如下图 1。该产品是在射线透视下,通过微导管将其输送至病变部位,然后释放编织丝网至目标血管中的血栓处。该产品的丝网在出微导管时能够保持其未出微导管时的收缩尺寸。当编织丝网的位置确定时,术者可通过手柄使编织丝网膨胀开。编织丝网的直径和径向支撑力可通过滑动手柄上的滑块调节。嵌栓完成后,术者在回撤时可适度收缩编织丝网,预期降低径向支撑力来减少对血管的损伤。编织丝网的闭合末端预期减少远端栓塞的风险。编织丝网的每根丝都含钽芯,预期增加可视性。
图 1 产品结构组成实物图
4、颅内取栓支架的产品技术要求研究项目
(1) 外观
(2) 产品尺寸
(3) 抗拉强度
(4) 抗扭结性
(5) 径向支撑力
(6) 模拟使用
(7) 输送、释放和回撤力
(8) 耐腐蚀性
(9) 微粒
(10) 编织丝网相变温度
(11) 化学性能
(12) 还原物质
(13) 重金属含量
(14) 酸碱度
(15) 蒸发残渣(不挥发物)
(16) 紫外吸收度
(17) 环氧乙烷残留量
(18) 无菌
(19) 细菌内毒素
5、颅内取栓支架的性能研究
开展了技术要求中各项目的指标和测试方法确定依据及有关支持性研究,并且对产品的可视性、控制丝涂层完整性、模拟使用后微粒、疲劳等进行研究,结果表明产品符合设计输入要求。
6、颅内取栓支架的生物相容性研究
该产品为外部接入器械,与循环血液短期接触。开发人依据 GB/T 16886 系列标准对产品进行了生物相容性评价,产品生物相容性风险可接受,具体评价项目详见表 。
表 生物相容性试验项目
|
评价项目 |
申报产品 |
|
热原 |
✔ |
|
细胞毒性 |
✔ |
|
致敏 |
✔ |
|
皮内反应 |
✔ |
|
急性全身毒性 |
✔ |
|
溶血 |
✔ |
|
补体SC5b-9 |
✔ |
|
体内血栓形成 |
✔ |
|
部分凝血激活酶时间 |
✔ |
7、颅内取栓支架的灭菌研究
该产品无菌状态提供,采用环氧乙烷灭菌。开发人开展了灭菌过程确认,证明无菌保证水平为 10-6。
8、颅内取栓支架的产品有效期和包装研究
该产品货架有效期为 2.5 年。开发人开展了有效期的研究报告,分别对包装系统开展了 2.5 年的加速老化和实时老化研究,对终产品开展了 2.5 年的加速老化和实时老化研究。包括产品稳定性、包装完整性和模拟运输验证。
9、颅内取栓支架的动物研究
开发人开展了动物研究以确认产品使用可行性及安全性。开发人在猪模型上与已上市产品进行了对比研究,共设置了两组研究, 分别用于评估取栓安全性和体内血栓形成。评价时间点包括手术后即刻以及术后 30 天。研究评估了模拟取栓操作性、血管损伤情况、局部或血管下游血栓形成、相关的血块破碎和栓塞或缺血情况。
动物研究结果表明产品达到了预期设计要求。