今日头条
苏州唯久NLRP3抑制剂获批CNS临床。唯久生物自研口服小分子NLRP3抑制剂获FDA批准,即将在美国开展首次人体I期临床。这是一款靶向CNS的NLRP3抑制剂,拟开发用于治疗与中枢神经炎症相关的PD、AD等退行性疾病。研究表明,异常过度的NLRP3激活导致促炎因子IL-1β的大量生成与释放,进而引发炎症反应并介导不同疾病的发生发展。
国内药讯
1.正大天晴NASH新药上III期临床。正大天晴引进的口服PPAR激动剂lanifibranor(拉尼兰诺)登记启动一项国际多中心III期临床,评估用于无肝硬化、伴2期(F2)/3 期(F3)肝纤维化的非酒精性脂肪性肝炎(NASH)成人受试者中有效性和安全性。该项研究的中国主要研究者由吉林大学第一医院医学博士牛俊奇和重庆医科大学附属第二医院医学硕士任红共同担任。今年7月,该新药针对这一适应症已被CDE纳入突破性治疗品种。
2.康方IL-4Rα单抗早期临床积极。康方生物自研新型人源化白介素-4受体α单抗AK120治疗中重度特应性皮炎(AD)的Ⅰ期临床研究成果发表于《皮肤病学与治疗》(Dematology and Therapy)。AK120旨在通过与IL-4Rα特异性结合以阻断IL-4与IL-13介导的信号通路,抑制相关免疫炎症反应的发生。数据显示,AK120可明显改善患者湿疹面积和严重程度指数(EASI)评分,增加患者整体(IGA评分)0/1的比例;药物总体耐受性良好。
3.信达EGFR/B7-H3双抗获批实体瘤临床。信达生物1类生物药IBI334获国家药监局临床许可,拟开展用于治疗不可切除、局部晚期或转移性实体瘤患者的临床试验。IBI334是一款EGFR/B7-H3双抗,可通过抑制EGFR信号阻断肿瘤细胞的增殖,以及通过阻断B7-H3信号激活T细胞,增强其对肿瘤细胞的攻击。今年3月,该新药已在Clinicaltrials.gov网站上登记注册一项用于实体瘤治疗的Ⅰ期临床。
4.恒瑞CDK4/6抑制剂获批前列腺癌临床。恒瑞医药CDK4/6抑制剂羟乙磺酸达尔西利片获国家药监局批准开展Ⅰb/Ⅲ期临床,拟联合醋酸阿比特龙片(I)和泼尼松片(AA-P)用于治疗转移性激素敏感性前列腺癌。该新药是首个国产CDK4/6抑制剂,已于去年年初获批上市,联合氟维司群治疗激素受体阳性、人表皮生长因子受体2阴性的复发或转移性乳腺癌患者。
5.葛兰素史克IL-18单抗中国报IND。葛兰素史克1类生物制品GSK1070806注射液的临床试验申请获CDE受理。GSK1070806是一款针对可溶性细胞因子IL-18的人源化单抗,目前已在海外登记启动一项用于治疗特应性皮炎的Ⅱ期临床。全球范围内尚无靶向IL-18药物获批上市;同类产品进展最快的是AB2 Bio公司旗下Tadekinig alfa(IL-18BP)新药,正在Ⅲ期临床中评估用于治疗噬血细胞性淋巴组织细胞增生症(HLH)的有效性与安全性。
国际药讯
1.创新CXCR4抑制剂获批上市。BioLineRx公司CXCR4抑制剂Aphexda(motixafortide)获FDA批准上市,联合filgrastim(粒细胞集落刺激因子G-CSF)动员造血干细胞至外周血,用于多发性骨髓瘤患者在移植时促进患者自体移植的干细胞动员(SCM)。在临床试验中,Aphexda联合G-CSF方案使得67.5%的患者在两次单采治疗中达到干细胞实现采集每公斤≥600万个CD34阳性细胞的目标,而安慰剂加G-CSF方案组这一数值仅为9.5%。
2.FDA批准两款XBB.1.5新冠mRNA疫苗。Moderna公司宣布其针对XBB.1.5亚型毒株新冠mRNA疫苗获得FDA批准上市,预计未来几周内上市,供秋季疫苗加强接种以应对新一轮新冠病毒感染。同日,辉瑞与BioNTech也发布公告,宣布双方合作开发的XBB.1.5新冠mRNA疫苗获批在美国上市。在临床前研究中,这两款疫苗对XBB.1.5、BA.2.86(Pirola)、EG.5.1(Eris)流行株均有保护效力。美国目前的流行株为EG.5等。
3.吉利德Trop-2靶向ADC乳癌Ⅲ期临床成功。吉利德靶向Trop-2的抗体偶联药物(ADC)Trodelvy(sacituzumab govitecan)治疗晚期HR+/HER2-乳腺癌的Ⅲ期临床(TROPiCS-02)最新结果积极。此前该项试验已达到主要终点,Trodelvy较化疗使患者的疾病进展或死亡的风险下降34%(中位PFS:5.5个月vs4个月,p=0.0003)。新的分析结果显示,与单药化疗相比,Trodelvy延长患者的总生存期(中位OS:14.4个月vs11.2个月,HR:0.79,p=0.02)。药物的安全性与之前研究一致。
4.默沙东PAH新药最新Ⅲ期数据积极。默沙东潜在“first-in-class”IIA型激活素受体(ActRIIA)融合蛋白sotatercept(MK-7962),在辅助治疗肺动脉高压(PAH)的Ⅲ期临床STELLAR最新数据积极。此前,sotatercept较安慰剂显著改善患者24周后6MWD(6分钟步行距离)指标,达到主要终点和多个次要终点。新的分析数据显示,sotatercept治疗显著改善平均肺动脉(PA)压(-13.9 mmHg)、肺血管阻力(-254.8 dyn·s·cm-5)、平均右心房压(-2.7 mmHg)、混合静脉血氧饱和度(3.84%)等多项指标。
5.武田TYK2抑制剂银屑病关节炎Ⅱb期临床积极。武田口服TYK2抑制剂TAK-279治疗活动性银屑病关节炎的Ⅱb期试验达到主要终点。与安慰剂相比,TAK-279治疗组第12周时达到疾病体征和症状至少改善20%的患者比例更高;药物的安全性与既往研究一致。武田计划尽快启动TAK-279治疗银屑病关节炎的Ⅲ期研究,并计划在系统性红斑狼疮、克罗恩病、溃疡性结肠炎等炎症性疾病中评估TAK-279的治疗潜力。
6.Kriya公司引进NASH一次性基因疗法。Kriya公司宣布完成收购巴塞罗那自治大学(UAB)的衍生公司Tramontane,并获得该公司临床前期、针对神经退行性和代谢性疾病领域的成纤维细胞生长因子21(FGF21)的一次性肌肉注射候选基因疗法。这款基因治疗产品通过腺相关病毒(AAV)为载体,旨在表达稳定水平的天然FGF21蛋白。该蛋白已被确定为针对非酒精性脂肪性肝炎(NASH)的经临床验证的生物靶点。
医药热点
1.福建省心脏瓣膜病介入中心联盟成立。9月7日,福建省心脏瓣膜病介入中心联盟在厦门正式成立,该联盟由厦门大学附属心血管病医院牵头成立,首批23家省内医院加入,标志着福建省瓣膜病介入诊疗事业迈上新的发展台阶。未来,该联盟将通过定期举办学术活动,加强患者教育、技术推广、人才培养、数据质控等多方面,不断提升区域瓣膜病介入诊疗水平,惠及更多患者。
2.8月新增501例猴痘病例。9月8日,中疾控发布8月猴痘疫情监测情况。2023年8月1日-31日,中国内地(不含港澳台)新增报告501例猴痘确诊病例,相较7月增加10例;98.9%病例为男性,92.5%病例明确为男男性行为人群;病例中有5例女性,发病前21天内均有异性性接触史,通过异性性接触感染可能性大,异性伴侣中3例为猴痘感染者、1例近期有出疹史、1例无猴痘相关症状。值得关注的是,这是自2022年9月以来中疾控首次报告女性猴痘感染病例。
3.反腐不得随意打击正规学术会议。近日,中国医院院长论坛在南京召开。该会议上,国家卫健委医疗应急司司长郭燕红以“把稳政策基调,推进医药腐败集中整治”为主题进行讲话。其中提到,反腐要“集中突破,纠建并举”,聚焦两个“关键”,要与医药界辛勤付出、无私奉献的绝大多数分开,不得与医务人员正常收入所得相混淆,不得随意打击医务人员参加正规学术会议的积极性,不得随意夸大集中整治工作范围。
评审动态
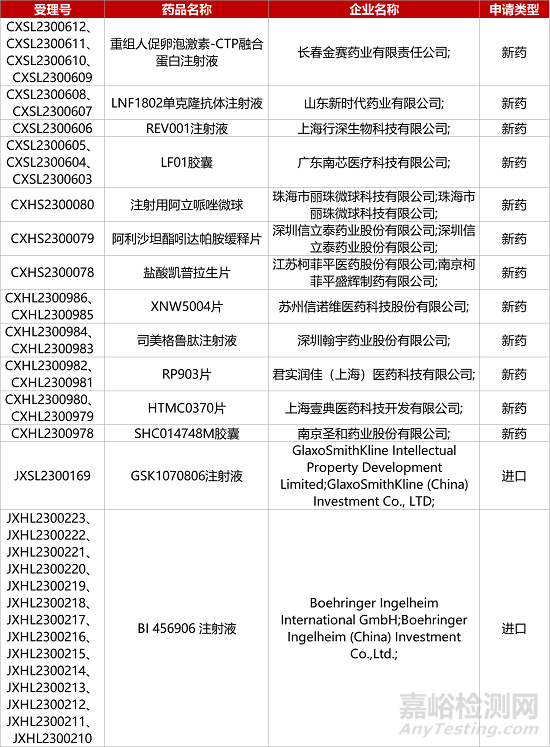
1. CDE新药受理情况(09月12日)
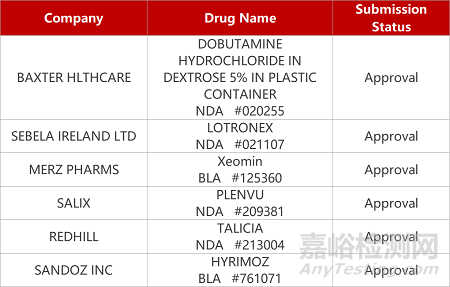
2. FDA新药获批情况(北美09月11日)