您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-30 11:48
近日,波士顿科学(NYSE: BSX)旗下AGENT紫杉醇涂层PTCA球囊导管(DCB)(简称”AGENT DCB“)获得国家药品监督管理局(NMPA)批准,用于冠状动脉支架内再狭窄(ISR)的治疗。支架内再狭窄是指在原植入支架内再次发生直径狭窄程度>50%的病变。
2024年3月,Agent DCB 获得 FDA 批准,成为美国首个用于治疗冠状动脉疾病患者的支架内再狭窄(ISR)的冠状动脉 DCB。
作为全球首款获得美国FDA批准上市的冠脉DCB产品,AGENT DCB是目前唯一同时获得欧盟 CE、FDA 及 NMPA 批准的冠脉DCB产品,将为中国冠脉介入治疗带来更多元的选择。
目前,该球囊导管已在许多国际市场上市销售,并治疗了包括欧洲、亚太部分地区和拉丁美洲在内的超过10万名患者,其中该器械在2023年被日本药监主管部门批准,并早在2014年就获得了CE标志,2021年还获得FDA授予“突破性器械称号”。
关于Agent DCB
Agent DCB 是一款采用 TransPax 涂层技术的载药球囊,用于治疗 ISR 和先前未接受治疗的冠状动脉小血管疾病患者。通过 TransPax™ 涂层技术,可向冠状动脉病变部位提供靶向治疗剂量的抗增殖紫杉醇。它还能最大限度地减少微粒,同时保持出色的输送能力。
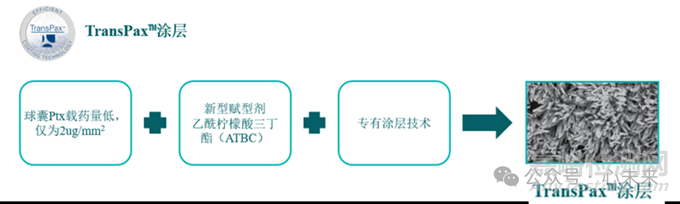
▲源于公司官网
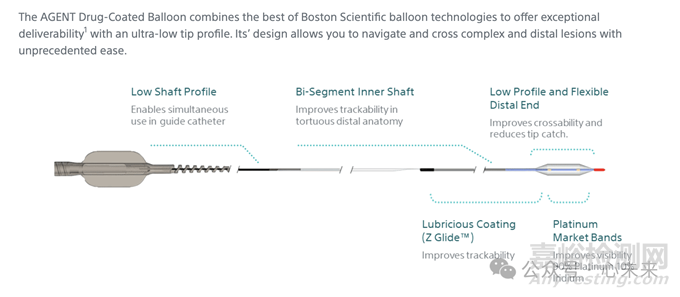
Agent DCB 载药球囊采用了先进的球囊技术,具备超低的尖端轮廓,确保了在心血管介入手术中穿越复杂和远端病变的便捷性。
该球囊的低轴线轮廓设计支持在导管内同时使用,其双段内轴结构改善了在曲折远端解剖中的可追踪性,而低轮廓和灵活的远端设计则优化了球囊穿越狭窄部位的能力并降低了滑脱风险。

▲源于公司官网
此外,球囊表面的润滑涂层(Z Glide™)进一步提高了追踪性,而铂金标记带则强化了在操作过程中的可视性,使得球囊位置更加清晰,提高了手术的精准性和安全性。
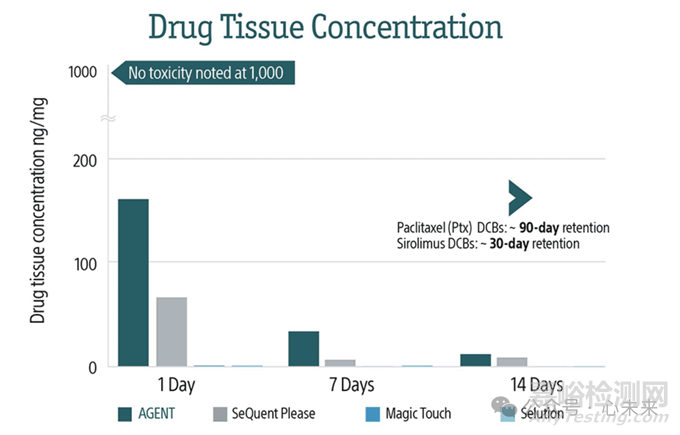
临床试验结果
在2022年的TCT会议上,波士顿科学公布了Agent DCB的 IDE 临床研究数据。AGENT IDE是一项关键随机试验,旨在比较 ISR 患者中 Agent 紫杉醇涂层球囊(Agent DCB)和传统球囊血管成形术治疗的安全性和有效性。
从美国40个中心入选480例曾接受过支架置入治疗、冠脉阻塞的ISR患者。患者在靶病变成功预扩张后以2:1的比例随机分配接受Agent DCB(n=321)或球囊血管成形术(BA,n=159)治疗。主要终点为1年时靶病变失败(由阻塞复发、治疗血管所致心脏病发作或心源性死亡组成的复合终点)的发生率。
结果显示,12个月时达到了靶病变失败(TLF)的主要终点。Agent DCB 组1年时靶病变失败率较BA组显著降低(17.9% vs. 28.7%,P=0.0063,),提示Agent DCB 在减少靶病变失败率上显著优于BA。

▲主要终点结果(源于公司官网)
与 BA 相比,应用 Agent DCB 使累积靶病变血运重建风险显著降低51%(12.4% vs. 24.0%,P=0.002),与靶血管相关的心脏病发作风险显著降低49%(6.4% vs. 12.3%,P=0.03);且无支架血栓形成发生(0.0% vs. 3.9%,P=0.001)。
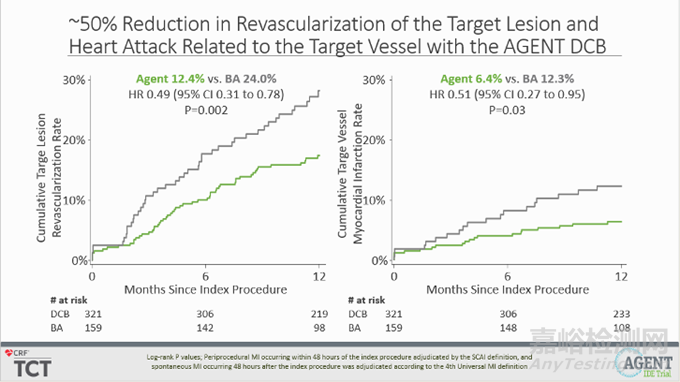
▲靶病变血运重建率和靶血管相关心肌梗死率(源于公司官网)
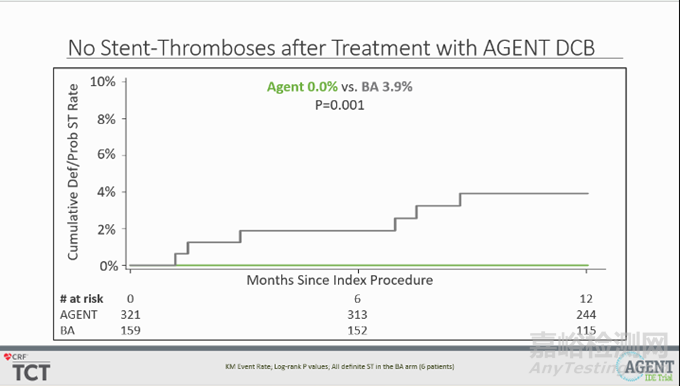
▲支架血栓形成结果(源于公司官网)
药物涂层球囊市场概况
裸金属支架(BMS)的出现在一定程度上解决了球囊扩张后可能会面临的血管壁夹层、血管急性闭塞和血管弹性回缩等问题,但却带来了另一个严峻的挑战,即支架内再狭窄。金属支架对血管内膜的持续性刺激,可导致血管内膜增生过度,引起支架内再狭窄(ISR),发生率可达30%。
药物涂层球囊扩张术使药物作用于血管内壁,维持血管通畅效果更佳且不留异物在血管内,在血管内再狭窄ISR、小血管、分叉病变有明显优势,原发病变的扩展也不断探索验证。
随着近年来“介入无植入”理念的推广,药物涂层球囊使用量快速增长。根据弗若斯特沙利文预测数据,药物涂层球囊首次在中国获批用于冠状动脉疾病的治疗后,使用量从 2016 年的 7500 个大幅增长至 2021 年的 29.0 万个。预计 2025 年市场规模将进一步攀升至 100.0 万个,2030 年预计将达到 204.2 万个。
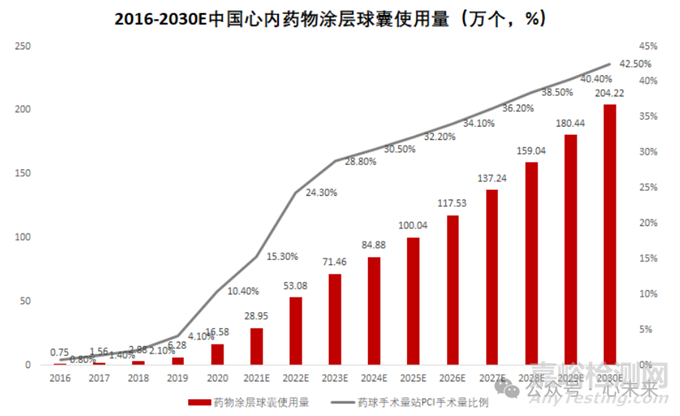
▲源于弗若斯特沙利文
根据弗若斯特沙利文预测数据,国内冠脉药物涂层球囊的市场规模从 2016 年的 1.35 亿元大幅增长至 2021 年的 20.09 亿元,预计 2025 年市场规模将进一步攀升至 43.86 亿元,2030 年预计将达到 59.33 亿元。
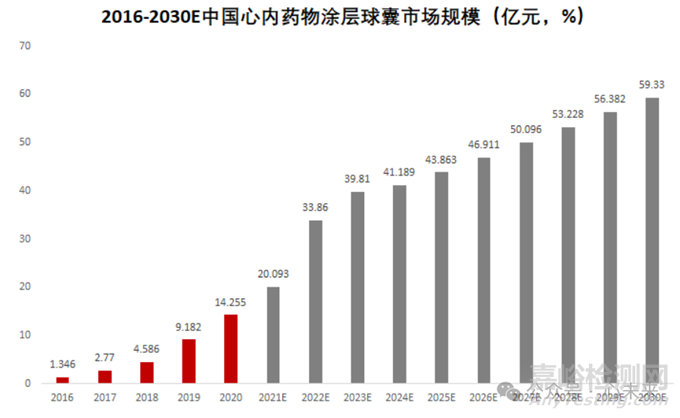
▲源于弗若斯特沙利文
冠脉药物涂层球囊是高端第三类医疗器械,产品具有高精密技术,进入壁垒较高的特点。我国药物球囊行业发展起步较晚,发展时间较短,国内市场由数家公司主导,仍有较大的进步空间。
公开资料显示,药物球囊最早于2009年左右才在欧洲率先应用,全球市场上,美敦力、波士顿科学、德国贝朗、德国百多力是主要玩家,但该产品的广阔前景也吸引多家国产械企相继布局。
德国贝朗的 SeQuent Please 是我国最早上市的药物涂层球囊,其适应症为冠状动脉支架内再狭窄治疗。垠艺生物的轻舟®药物洗脱球囊于 2017 年获原国家食品药品监督管理总局(CFDA)优先审批上市,是国际首个适用于原发冠脉分叉病变的产品,也是国内首个取得注册证的产品。2019年,第二个注册证被上海申淇摘得。
垠艺生物的轻舟®药物洗脱球囊具有出色的通过性及输送性、优异的药物涂层品质,已在多家知名心血管医院及国内逾千家医院进行临床应用,上市后销量增长较快,打破了德国贝朗的市场垄断。
2020年,是国产药物球囊里程碑式的一年:
4月20日,远大制药与德国Cardionovum共同开发的球囊获得NMPA批准;
4月28日,微创旗下心脉医疗拿到了外周药物球囊的国内审批;
7月14日,乐普医疗的药物球囊也于上市后进行了首例临床应用。
此外,蓝帆医疗旗下吉威医疗的药物球囊已于2021年8月进入国家药监局医疗技术评审中心的特别审查程序。
除了垠艺生物、上海申淇、乐普医疗、凯德诺(远大医药)、赢生医疗、巴泰医疗、鼎科医疗、先瑞达、心脉医疗等多家本土企业研发的药物涂层球囊产品获批上市,仍有数十家企业正在从事药物涂层球囊研发。 随着更多竞争对手和竞品进入市场,市场竞争将加剧,但竞品的进入也将进一步加强行业的国内市场教育,促进产品市场渗透率提高。
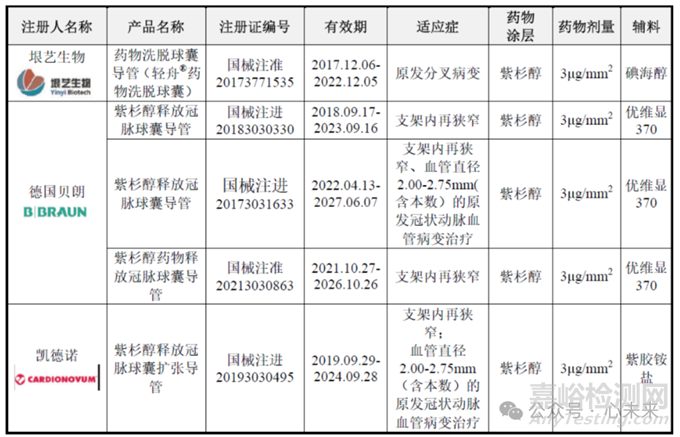
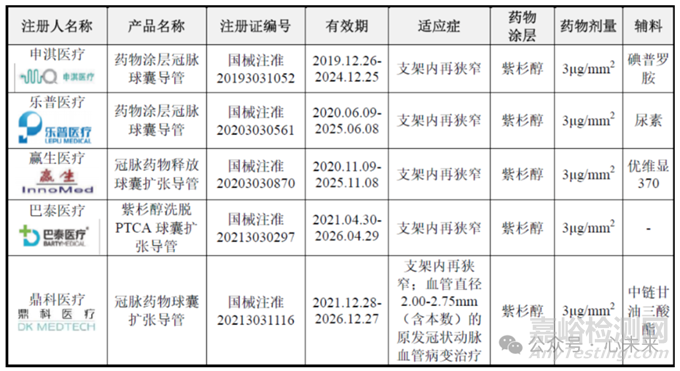
▲冠脉药物球囊竞品信息对比(源于垠艺生物招股说明书)
关于波士顿科学
波士顿科学(纽约证券交易所代码:BSX)创建于1979年,总部设在美国马萨诸塞州纳提克市,是全球领先的医疗科技公司。
1997年,波士顿科学进入中国,在北京、上海、广州均设立分公司以及研发中心,公司在中国的总部位于上海。波士顿科学拥有超过17000种产品,并在全球范围内获得了超过16000项授权专利。1992年5月,波士顿科学在纽约证交所成功上市。
2024年1月31日,波士顿科学宣布了2023财年年度业绩,报告显示这一财年该公司:年度净销售额为142.4亿美元(约1011亿人民币),同比增长12.3%;第四季度净销售额为37.3亿美元,同比增长14.9%;
按部门划分,公司业务分为医疗外科和心血管两大块,两大业务增速相当:前者全年有机增长10%,总净销售额为54.22亿美元;后者全年有机增长13%(其中电生理增长33%,Watchman左心耳封堵器增长25%),总净销售额为88.19亿美元。

来源:心未来


