您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-05 09:12
近两年,他达拉非、西地那非等口溶膜产品先后被CDE拒绝批准,以提高顺应性为目标且以BE/BA豁免确证性临床为策略的研究,其必要性、合理性、甚至科学性,都正在受到越来越多的质疑。改良型新药的行业水平正在迅猛发展,今年《化学药改良型新药临床药理学研究技术指导原则(试行)》的颁布,对其临床研究的系统型、科学性要求进行了进一步的明确。2.2类是对给药途径、剂型、处方和工艺等方面的改良,为改良型新药中报批最多的类别,本文剖析了当前已上市2.2类改良型新药的临床优势、临床研究内容,以国内外批准的典型改剂案例阐述了该类改良的临床研究策略。
一、国内改良型创新现状
在2016到2020年间改良型新药的IND和NDA批准数量均在迅速增长[1],从CDE受理品种公示可见,其年IND申报量从2017年的75件到2021年已超过300件,之后趋于稳定。从注册分类上看,2016年至今,国内改良型新药的报批主要集中于2.2类和2.4类[1] [2],如图1所示[1]。
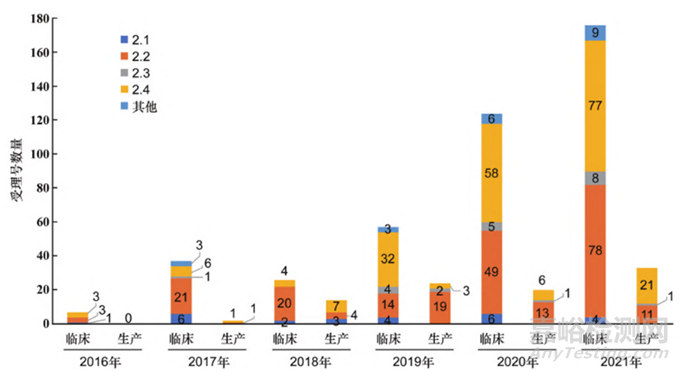
图1:2016~2021年化学药改良型新药申报情况
如上图所示,2.4类和2.2类的申报最多,其中2.4类主要为1类新药增加适应症,本文中不作讨论,2.2类主要是对已知化合物的给药途径、剂型、处方等进行的改良,以改善安全性、有效性或依从性为目标,2021~2023年已获批的2.2类改良型新药如下表所示。
表1 2021~2023年国内已获批的2.2类改良型新药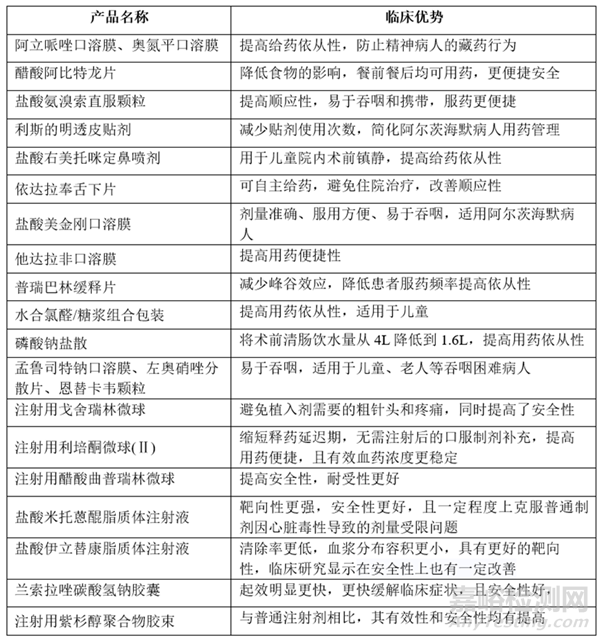
上表中,盐酸美金刚口溶膜、恩替卡韦颗粒等产品以提高可吞咽性为改良目标,通过与被改良产品BE等效而豁免确证性临床上市;紫杉醇胶束、盐酸米托蒽醌脂质体、戈舍瑞林微球等改变了药物的组织分布,通过临床药理学研究确认给药剂量和方案后,完成了安全性/有效性研究;注射用利培酮微球(II)、兰索拉唑碳酸氢钠胶囊等以缩短药物起效时间为改良目标,仍然通过PK研究豁免了确证性临床,但其巧妙的临床策略仍然证明了产品的临床优势。
当前从立项、研发到市场的各项政策都着力于鼓励企业在临床研究中证明产品的安全性、有效性等方面的临床优势,而怎样制定合理的临床研究策略,通过合理的桥接、巧妙的临床研究、模拟分析等研究手段进行2.2类新药的开发,成为当前改良型创新能否取得成功的关键之一。随着相关法规及指导原则的逐渐完善[3][4],当前已明确,2.2类产品的临床策略取决于其PK特征是否发生改变。
二、案例
1、不改变PK的情形
不改变PK特征的改良,大多可通过与被改良药的BE等效来豁免确证性临床研究,包括颗粒剂、口崩片、口溶膜等剂型间的转换,也包括某些给药途径改变等情形,例如奥氮平口崩片被改良为口溶膜,依达拉奉注射液改良为舌下片等。依达拉奉注射液在国内上市多年,在将其改良为舌下片后,患者可自主给药,避免住院,提高顺应性的同时降低医疗资源的占用和频繁输液的风险,其临床研究内容如表2所示[5]:
表2:CDE公布的审评报告中依达拉奉舌下片的临床研究内容
如上表所示,依达拉奉舌下片虽然改变了给药途径,但在论证了其PK行为未发生改变后,仍然通过BE研究豁免了确证性临床试验。但需要注意的是,当改良后的产品中采用了新辅料、出现了新杂质等情形时,则还需通过临床试验证明产品安全性。
2、改变PK的情形
改变PK特征的改良通常需要完成充分的PK研究,剂量比例关系,与被改良药的PK对比,给药方案及剂量探索研究,可能时的PD研究等,根据前述研究结果评估后确定是否开展确证性临床试验。CDE审评报告中公布的相关产品临床研究内容如表3所示:
表3:当前国内已上市PK改变产品的临床研究策略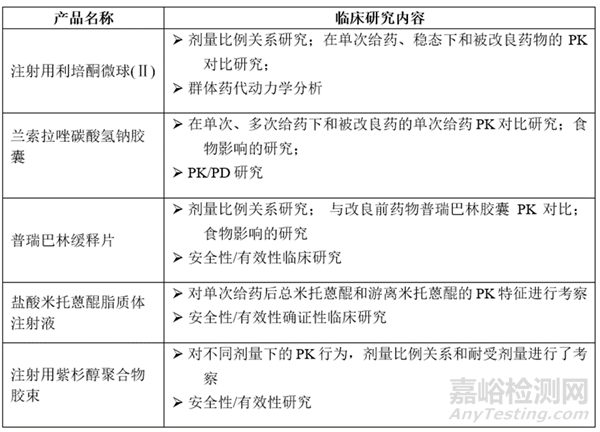
如上表所示,在不改变药物生物利用度、暴露量、组织分布等PK特征,仅对其达峰时间、起效时间等进行改变时,仍可以考虑在完成充分的PK研究、与被改良药物PK对比、相关模拟等研究后豁免确证性临床。如绿叶的利培酮微球[6]通过单次和多次PK研究,证明了与被改良药物的暴露量相当,通过量效关系分析和群体药代动力学模拟分析,最终豁免了确证性临床试验;四环制药的兰索拉唑碳酸氢钠胶囊[7],虽然Cmax较被改良药更高,但是通过PK-PD研究证明买了药效主要与暴露量相关,最终产品基于与被改良药的 AUC 生物等效,抑酸作用相关PD 指标相似, 成功以 PK/PD 生物等效性试验桥接被改良药已批准的适应症。
对改变了药物组织分布的改良,一般参照创新药的临床策略,如盐酸米托蒽醌脂质体注射液、注射用紫杉醇胶束等。在对给药途径、剂型或处方工艺等进行改良,使生物利用度发生改变时,通常基于剂量、给药方式等探索,使活性成分暴露与被改良药相当后,桥接其安全性和有效性数据。
以FDA批准的泊沙康唑肠溶片Noxafil® Tablets为例,该产品是对其口服混悬液的改良,其临床研究内容如下表所示[8]:
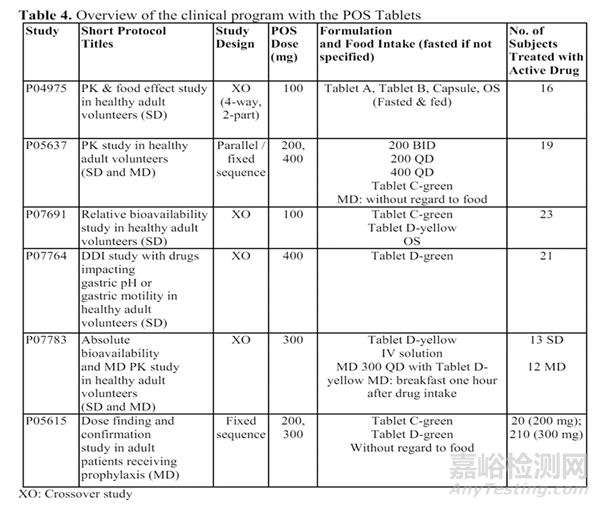
图2:泊沙康唑肠溶缓释片的改良历程
如上图所示,该产品通过PK研究中对片剂A、片剂B与改良前口服混悬液的PK行为进行了对比,并研究了食物对片剂PK的影响,结果显示A和B片剂生物利用度显著高于混悬液,几乎不受食物影响。评价了C和D片的相对生物利用度,最终用了暴露量与口服液相当的片剂D完成了DDI研究和确证性临床研究。
四、2.2类改良的其他考虑
2.2类对给药途径、剂型、处方工艺等的改良,是国内2016年至今的改良热点,在相当长的一段时间内,以改善可吞咽性等提高顺应性的改良为目标,以BE豁免确证性临床为策略,将片剂改为口溶膜、口崩片、颗粒剂等剂型的转化受到行业青睐。近两年,他达拉非口、西地那非等口溶膜产品先后被CDE拒绝批准,改良的必要性、合理性、临床优势等要求正不断被明确和强调。从中美已上市的产品看,只有真正解决了临床需求并且具有技术壁垒的改良型新药,才能获得市场的回报,在临床优势的证明上,需要通过巧妙的临床策略设计,进行合理的桥接和研究,节省临床研究投入的同时充分证明产品改良后具有的临床优势。
参考文献:
1. 吕奕,张怡萌,等.我国化学药改良型新药申报审批情况分析与思考[J].中国新药杂质,2023,32(15):1523-1530.
2. 李秋,戈乾玮,等.2023年度中国新药盘点[J].中国新药与临床杂质,2024,43(1):4-11.
3. CDE.化学药改良型新药临床药理学研究技术指导原则(试行). https://www.cde.org.cn/main/news/viewInfoCommon/25f498093f32286f0f31dbc4d1c8bb43
4. 刘美霞,贺锐锐,等.关于化学药品改良型新药临床药理研究的考虑[J].中国临床药理学杂质,2023,39(7):1060-1064.
5. CDE.依达拉奉(CXHS2101030)申请上市技术审评报告.https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=46b5cb3baacbbeb5add1c6f9d0b7059a
6. CDE. 注射用利培酮微球(II)( CXHS1900036-38)申请上市技术审评报告.https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=54cf8b30cc336348afea04f5cb9ce90c
7. CDE. 兰索拉唑碳酸氢钠胶囊(CXHS1900023)申请上市技术审评报告.https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=767e35446f10b0adc9ced6f9a61754b9
8. FDA.Noxafil® . CLINICAL PHARMACOLOGY AND BIOPHARMACEUTICS REVIEW(S). https://www.accessdata.fda.gov/drugsatfda_docs/nda/2013/205053Orig1s000ClinPharmR.pdf

来源:药事纵横


