您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-29 11:14
如果您在医疗器械行业工作,您会经常听到"可追溯性"这个词。本文概述了在医疗器械开发过程中需要建立的三种主要可追溯性:
-产品要求与测试之间的可追溯性
-测试测量结果与国家标准之间的可追溯性
-从制造商到最终客户的设备及其组件之间的可追溯性
这些可追溯性类型可使用不同的工具进行设计。专业的需求工程工具可以自动生成可追溯性报告。虽然也可以使用 Word 和 Excel 表格来证明可追溯性,但人为错误的可能性很大。
产品需求与测试之间的可追溯性
有了想法就开始实施设备是一种策略,但从最终用户的需求入手岂不是更好?从用户需求开始,我们收集用户需求规格(user requirement specification, URS),并从中得出产品的功能需求规格(functional requirements specification, FRS)。与此同时,风险管理过程也会产生风险控制措施,从而产生功能需求。然后,所有这些要求都必须在机械、电子、软件等子系统中实现。这些要求不仅要实施,还要进行测试,并建立相应的可追溯性。
显示可追溯性的最简单方法是创建一个或多个矩阵,如上图所示显示可追溯性。风险管理矩阵可以是这样的
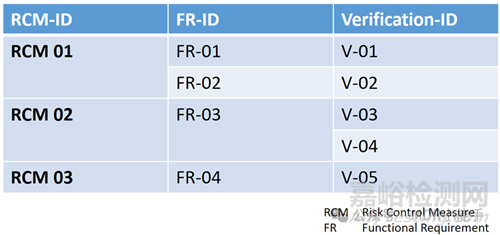
在本例中,风险控制措施 [RCM 01] 在功能要求 [FR-01] 和 [FR-02] 中实施。然后在测试 [V-01] 中验证功能要求 [FR-01]。
通过可追溯性矩阵,技术文件审核员可以快速检查所有风险控制措施是否都已实施并进行了验证测试。
测试测量结果与国家标准之间的可追溯性
在验证过程中,通常必须测量一些东西:时间、距离、电压或气体流量。要测量距离,我当然可以用桌上的尺子,但我测量的 25 毫米真的是 25 毫米吗?我如何确保这一点?测试设备必须经过校准,这样才能为您提供参考值及其测量不确定性。
校准可以在自己的校准实验室或外部校准实验室(例如检测设备制造商)进行。如果在自己的校准实验室校准设备,还需要校准参考值,并再次校准这些参考值,以此类推。这一链条应追溯到根据国家标准进行的校准,并可随时重建这一链条。这就是检测结果与国家标准之间的可追溯性的作用所在。
确保这种可追溯性的一种方法是,只使用经认可的校准实验室提供的校准服务,因为认可机构会通过定期检查确保这种可追溯性。
从制造商到最终客户的器械及其组件之间的可追溯性
医疗器械必须建立的第三种可追溯性是器械及其部件从制造商到最终客户之间的可追溯性。其目标是,如果在终端客户处发现故障,制造商可以在发货后召回器械。为了缩小召回范围,还应该了解用于制造器械的不同(关键)组件。如果供应商发现错误,制造商只需召回受影响的系列医疗器械,而不必召回整个生产批次。
大多数ERP系统都提供了建立此类可追溯性的选项,但 SharePoint 列表也可以完成这项工作。

来源:MDR小能手


