您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-30 09:38
最新要求
分类界定网页登录进去后,会弹出最新的要求,按照2024年9月1日起实施的最新公告(国家药监局关于规范医疗器械产品分类界定工作的公告(2024年第59号))的要求编写文件,提交即可。
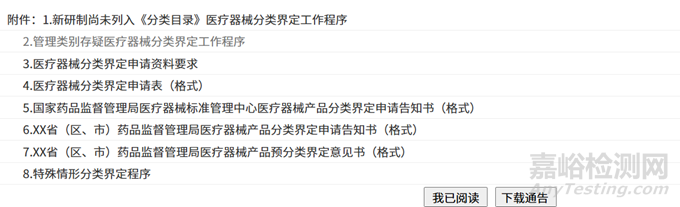
相关附件也可以直接下载:
问题列表
1、关于分类界定新增的不涉案证明、符合性声明、证明性材料
答复:没有模板,写清楚企业需要承诺的内容即可。
2、不涉案声明怎么写?
答复:模板仅供参考。
不涉案声明
我司研发的XXX产品,主要用于XXXXX,因为XXXX,现申请分类界定。
申报产品在研发、生产及申请分类界定过程中,严格遵守国家法律法规和行业标准,截至本声明提交之日,未涉及任何刑事案件,民事诉讼,信访举报,稽查办案等情形。产品不存在非法生产、销售、使用等违法行为,也未受到任何司法机关的调查或处理。
本单位确保所提交的所有资料真实、准确、完整,不存在任何虚假或误导性信息。
特此声明!
XXXXX公司
XX年XX月XX日
3、符合性声明怎么写?
答复:模板仅供参考。
符合性声明
我司研发的XXX产品,主要用于XXXXX,因为XXXXX,现申请分类界定。
本次申报过程中所提交的XXX产品分类界定资料,严格依据《医疗器械监督管理条例》、《医疗器械分类规则》、《医疗器械分类目录》及相关法律法规、指导原则进行编制,所有申请资料及相关信息均合规、真实、准确、完整和可追溯,不存在任何违法违规情形。
特此声明!
XXXXX公司
XXXX年XX月XX日
4、证明性材料需要提交什么?
答复:公告提到的有关证明性材料或者其他材料的要求如下:


可以点开系统界面(需要提交的文件可能不同),按照提示准备即可。界面没有营业执照,证明材料上传营业执照。界面有营业执照,可以提供企业初步认定的分类结果的相关支持性材料,比如临床评价资料、检验报告、试验数据等。


5、跟踪提交状态
答复:提交分类界定后,要留意分类界定列表已生成申请编号、上传日期。当前状态已更新,说明已提交成功。

来源:医械铁锅炖


