您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-15 12:23
GSPR检查表的十条成功法则
1. 创建合规的GSPR(通用安全和性能要求)检查表。
2. 仔细检查每项GSPR条款并牢记你的特定器械。
3. 辨别GSPR条款适用与否。
4. 考虑证明合规性的方法。
5. 为符合要求而应用解决方案。
6. 精准定位表明你符合要求的证据。
7. 可能时提供指向证据位置的超链接,使审阅者尽可能便捷地检查和交叉引用文件。
8. 对所有被指示为不适用你器械的GSPR条款,需确保在检查表中充分声明该事实,并且此声明的准确性无任何疑问。
9. 在检查表中添加你引用的标准标签,并在适用情况下填写其修订信息。
10. 记录作者和审批人信息,包括姓名、职位、签名和日期。
考虑证明合规性的方法
方法包括:协调标准(Harmonized Standards)、通用规范(CS)、ISO标准、CLSI指南、MDCG文件、当前技术水平state of the art、制造商内部制订的体系文件等。
MDR/IVDR法规附录I第4节GSPR要求规定:文档应包含符合附录I规定的通用安全和性能要求的证明信息,符合性证明应包括↘
·适用器械的通用安全和性能要求,并解释其他要求不适用的原因;
·符合各项通用安全和性能要求的证明方法;
·所用协调标准、通用规范、指南、其他解决方案;
·提供符合协调标准、通用规范、指南、通用安全和性能要求的证据的确切受控文件,该信息应在完整技术文档和技术文档摘要中交叉引用前述证据位置。
1. 通用规范指南

2. 当前技术水平(SOTA)
可从标准、指南等文件获取当前技术水平的知识。
·欧盟在IVDR实施后公布的协调标准中,与分析性能和稳定性相关的有:EN ISO 23640:2015 体外诊断医疗器械的稳定性评价;EN ISO 13612:2002/BS EN 13612:2016 体外诊断医疗器械的性能评价。
·MedTech Europe(欧洲医疗技术协会)立场文件《无IVDR和MDR协调标准的情况下现有国际公认技术标准的使用》。
·现有国际公认技术标准应用的优先顺序:
①当前协调标准的最新版本;
②被确定为协调标准候选的其他已发布标准;
③适当的国际和欧洲共识标准(ISO、IEC、EN)。
注意:应用标准的确定仍需同公告机构商议。
精准定位表明你符合要求的证据
可能包括:测试报告、第三方机构颁发的证书(如ISO13485证书)、风险管理文件、内部标准操作程序(SOP)、性能评估报告、临床评估报告、其他GSPR相关文件。
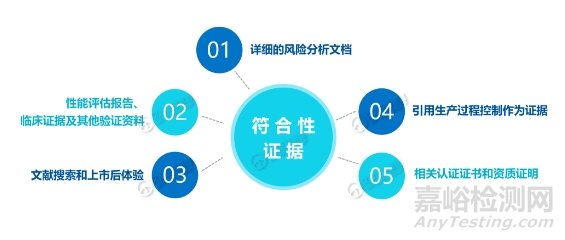
发补中GSPR的重点注意事项
·适用或不适用的需求:实践中通常使用清单或表格实现,包括:适用性列表、各需求的Yes/No回答。当适用某项要求时,可简单声明该要求适用于该器械;当某项要求不适用时,必须作出声明,并在“适用”一栏填写“否”,不适用声明必须是充分且适当的理由,清晰说明不适用原因,以便公告机构理解,例:该器械未通电,因此并非有源器械。
·证明方法:与制造商遵守GSPR要求的方式有关,被列为"标准或证明合规性的其他参考文件",例如:风险分析与临床评估益处的权衡;设计要求、验证和确认所展示的性能。
·在完整的技术文档和技术文档摘要中交叉引用证据位置:意味着文档查阅者应当能够精准确定技术文档中“遵从性证据”的位置。
·如果将可用性风险作为更大风险评估的一部分,可能需说明"参见技术文档XXX,第XX节,文档RMF001第3行65-78",需注意文件位置不应当引发歧义。

来源:久顺集团技术服务


