您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-02 22:46
麻醉咽喉镜包括重复使用的麻醉咽喉镜和一次性使用麻醉咽喉镜,对于仅包括窥视片、不包括手柄的产品。
一、麻醉咽喉镜的结构与工作原理
1.麻醉咽喉镜的结构
麻醉咽喉镜由窥视片和手柄组成,按照结构的不同,分为连体式和分体式;按照光源不同,分为LED光源式、灯泡光源式;按照导光方式不同,分为直接照明式和纤维导光束照明式;窥视片可按照形式的不同,分为弯型、直型、弯钩型等;按照使用次数可以分为可重复使用和一次性使用产品。
说明麻醉咽喉镜的结构,出具产品结构示意图及实物图(如图1、图2)。
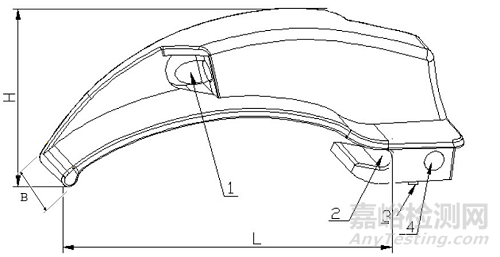
1—光源;2—铰链槽;3—电接触点;4—锁定表面;
B—窥视片的宽度;H—窥视片前部尖端至镜片最高处的距离;L—窥视片的有效长度
图1 窥视片示意图

图2 典型麻醉咽喉镜实物图
2.麻醉咽喉镜的工作原理
麻醉咽喉镜由窥视片和手柄组成,当电源接通后,窥视片插入患者的口腔中并压住舌部,光束可集中照射于咽喉部位。供临床喉部检查、协助插管用。
二、麻醉咽喉镜的研发实验要求
1.性能研究
应详述产品技术要求中主要性能指标及检验方法的确定依据,出具采用的原因及理论基础,给出涉及的研究性资料、文献资料和标准文本。如适用的国家标准、行业标准中有不采纳的条款,应将不采纳的条款及其理由予以阐明。
应研究的产品基本性能至少包括使用性能、外观、表面粗糙度(如适用)、镀层(如适用)、尺寸、照度、安全性能、电磁兼容(如适用)、环境试验、无菌(如适用)、环氧乙烷残留量(如适用)等。
若产品带有配合使用的附件,应分别列出附件的材料、尺寸、性能要求。
出具产品抗折断方面的研究资料。
对分体式产品中窥视片与手柄的锁定和解锁的安全性进行研究,并出具相关研究资料。
应给出产品的主要原材料选择依据等信息。
对于采用新材料制造的产品以及具有其他特殊性能的产品,应根据产品特点制定相应的性能要求,设计验证该项特殊性能的试验方法,阐明试验方法的来源或出具方法学确认资料。
2.生物相容性的评价研究
窥视片和手柄在临床使用时需组合后使用,会与口腔及咽喉黏膜组织接触,因此,应评价包括窥视片和手柄在内的整体产品的生物学风险。应按GB/T 16886.1—2011的要求进行评价并出具资料。其中应描述产品采用的材料、粘接剂(如适用),以及在使用过程中与口腔及咽喉黏膜组织接触的性质和时间,应确定的生物相容性评价项目及要求等内容,给出相应的生物学试验资料的支持。由于本产品属于短期表面器械接触黏膜器械,一般应评价的项目至少包括细胞毒性、致敏和粘膜刺激等。
3.灭菌工艺研究
(1)以无菌形式供应的产品,应明确灭菌工艺(方法和参数)及其选择依据和无菌保证水平(SAL),并出具灭菌确认报告。麻醉咽喉镜的无菌保证水平(SAL)应达到1×10-6。
(2)残留毒性:若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并出具研究资料。
(3)对于重复使用的产品,应出具终端用户灭菌或消毒方面的研究资料,包括重复灭菌或消毒次数进行研究。
4.产品有效期和包装研究
出具产品有效期的验证报告(包括产品物理、化学稳定性和包装密封稳定性的验证资料),不同包装的产品需分别出具,且应符合相应标准要求。有效期的确定可使用加速老化试验进行验证。
申报产品如为有限次重复使用,应当出具次数验证资料。
包装研究资料中应包括包装材料、包装方法、验证过程和结论。
5.主要性能指标
(1)一次性使用的麻醉咽喉镜因其材质与重复使用的产品不同,性能指标与YY 0499—2004、YY 0498.1—2004、YY 0498.2—2004中具体要求可能存在不适用的情况,在制定技术要求时,应充分考虑产品自身特点,对于不适用的内容,应在性能研究资料中详细说明原因,出具有关证据。可考虑根据产品实际特点增加相关指标要求。
(2)在进行GB 9706.1—2007检验时,应对电磁兼容性能按照YY 0505—2012的要求检验。对于仅包含光纤,无光源的窥视片产品,可不要求电磁兼容检验。安规检验报告和电磁兼容检验报告应具有关联性。
三、相关标准
如表1列出麻醉咽喉镜主要涉及的现行有效的国家/行业标准;如有标准发布或更新,应当考虑新版标准的适用性。
表1. 产品适用标准
|
标准编号 |
标准名称 |
|
GB/T 191—2008 |
包装储运图示标志 |
|
GB/T 2828.1—2012 |
计数抽样检验程序第1部分:按接受质量限(AQL)检索的逐批检验抽样计划 |
|
GB/T 2829—2002 |
周期检验计数抽样程序及表(适用于对过程稳定性的检验) |
|
GB 9706.1—2007 |
医用电气设备第1部分:安全通用要求 |
|
GB/T 14233.1—2008 |
医用输液、输血、注射器具检验方法第1部分:化学分析方法 |
|
GB/T 14710—2009 |
医用电器环境要求及试验方法 |
|
GB/T 15593—1995 |
输血(液)器具用软聚氯乙烯塑料 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5—2003 |
医疗器械生物学评价第5部分:体外细胞毒性试验 |
|
GB/T 16886.10—2005 |
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
|
GB/T 19633.1—2015 |
最终灭菌医疗器械包装第1部分:材料、无菌屏障系统和包装系统的要求 |
|
GB/T 19633.2—2015 |
最终灭菌医疗器械包装第2部分:成形、密封和装配过程的确认的要求 |
|
YY/T 0287—2017 |
医疗器械质量管理体系用于法规的要求 |
|
YY/T 0313—2014 |
医用高分子产品包装和制造商提供信息的要求 |
|
YY/T 0316—2016 |
医疗器械风险管理对医疗器械的应用 |
|
YY/T 0466.1—2016 |
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
|
YY 0498.1—2004 |
喉镜连接件第1部分:常规挂钩型手柄-窥视片接头 |
|
YY 0498.2—2004 |
喉镜连接件第2部分:微型电灯螺纹和带常规窥视片的灯座 |
|
YY 0499—2004 |
麻醉喉镜通用技术条件 |
|
YY 0505—2012 |
医用电气设备第1—2部分:安全通用要求并列标准电磁兼容要求和试验 |
|
YY/T 0681系列标准 |
无菌医疗器械包装试验方法 |
|
YY/T 0698系列标准 |
最终灭菌医疗器械包装材料 |
|
YY/ T1474—2016 |
医疗器械可用性工程对医疗器械的应用 |
|
ISO 14155—1:2003(E) |
用于人体的医疗器械的临床研究第1部分:一般要求 |
|
ISO 14155—22003(E) |
用于人体的医疗器械的临床研究第2部分:临床研究计划 |
|
/ |
中华人民共和国药典(2015版) |
四、主要风险
产品的风险管理报告应符合YY/T 0316—2016的有关要求。
表2. 麻醉咽喉镜产品常见危险(源)、可预见的事件序列、危险情况及可导致的伤害
|
危险(源) |
可预见的事件序列 |
危险情况 |
伤害 |
|
电能 |
绝缘效果不符合要求。 |
过量的漏电流。 |
导致对使用者/患者电击伤害。 |
|
扭转力 |
产品强度不足;与手柄连接不牢或连接失效。 |
窥视片折断、脱离。 |
引起患者不适甚至伤害。 |
|
生物 相容性 |
与人体接触的材料,不具有良好的生物相容性。 |
与被检查者接触的窥视片材料有致敏性、刺激性或细胞毒性。 |
产生致敏、刺激和细胞毒性反应。 |
|
未对灭菌过程进行确认或确认程序不规范。 |
产品带菌。 |
引起患者感染。 |
|
|
电磁能 |
1.产品设计时电磁屏蔽及电路抗扰设计不充分。 2.未规定设备的使用环境。 |
设备受到外界的电磁干扰。 |
不能正常工作。 |
|
1.屏蔽、滤波及接地技术不完善。 2.未规定设备的使用环境要求。 |
设备对外界的电磁干扰。 |
引起其他设备不能正常工作。 |
|
|
使用错误 |
1.未经培训的人员使用操作。 2.窥视片规格型号选用错误,导致机械损伤。 |
操作不正确。 |
引起患者不适甚至伤害。 |
|
与被检查者接触的部分清洁/消毒不充分或不正确。 |
1.产品带菌。 2.交叉感染。 |
引起患者感染。 |
|
|
不完整的说明书 |
操作说明不准确或不完整、缺少必要的警告说明。 |
错误使用,导致无法保证使用安全性。 |
引起患者不适甚至伤害。 |
|
1.标记不清晰、错误。 2.没有按照要求进行标记。 |
1.错误使用。 2.储存错误。 3.产品辨别错误。 4.导致无法保证使用安全性。 |
引起患者不适甚至伤害。 |

来源:嘉峪检测网


