您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2021-07-15 23:44
在实验室中,百分浓度使用广泛,计算方便。
百分浓度又分重量百分浓度和体积百分浓度两种。其中以重量百分浓度用的较多。
一、重量百分浓度
用100克溶液中所含溶质的克数来表示溶液的浓度,叫做重量百分浓度。即,溶质和溶剂的重量总和为100克或100克的倍数。如公式表示:
溶质(克)+溶剂(克)=100克溶液
由于溶质有固体和液体,又可分别用下列公式计算重量百分浓度:
1)如果溶质是固体
设:W为需配成溶液的总重量;
X%为需配制溶液的浓度;
V为需用溶剂的克(毫升)数;
x为需称取溶质的克数。
则 x=X% ×W
V=W-x
例如:配制15%碘化钾溶液200克
已知:W=200克 X%=15%
x=200×0.15=30克(固体碘化钾)
V=200-30=170克(溶剂的重量)
称取30克碘化钾加170克水溶解即可。
2)如果溶质和溶剂均为液体
设:W为需配制溶液总重量;
X%为需配制溶液的浓度;
a%为溶质的浓度;
d为溶质的比重;
V为应量取溶剂的体积或应称取重量(克);
V'为应量取溶质的体积(毫升)。
V'=W×X%×1/(d×a%)
V=W-(W×X%)
例如:要配制20%的硝酸溶液500克(由瓶签上注明已知:浓硝酸的浓度90%,其比重为1.49)。
则:W=500,X%=20%
a%=0.90,d=1.49
V'=(W×X%)÷(d×a%)
=500×0.20/1.49×0.90=74.57毫升
V=W-(W×X%)=500-500×0.20=400毫升
量取400毫升水,加入74.57毫升浓硝酸混匀即可。
二、体积百分浓度
以100毫升溶液中所含溶质的毫升数来表示溶液的浓度,叫做体积百分浓度。这是一种溶质和溶剂均是液体并且两者比重又相近,以体积比例来混合配制的溶液。如水和酒精混合配成稀酒精溶液时,就常用体积的百分浓度。
即:
溶质(毫升)+溶剂(毫升)=100毫升溶液
例如:配制60%的酒精溶液300毫升。
0.60×300=180毫升(95%以上酒精用量)
300-180=120毫升(水的用量)
将120毫升水和180毫升酒精混合即可。
三、百分浓度的特殊配制法
1)混合法
这种方法是用于已有两种不同浓度的相同试剂溶液来配制所需(第三种)浓度的溶液。如,已有某种试剂的两种浓度是85%和40%,要配制第三种浓度为60%。配法,按下列交叉法形式计算:
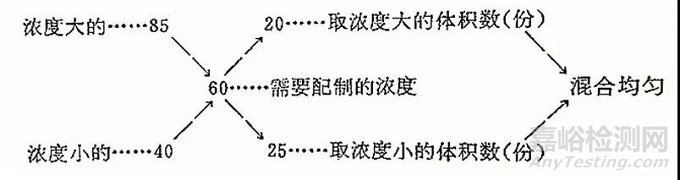
上列图式计算方法:将已有的两种浓度数写在左边,需配制的浓度写在中间,左边浓度大的、浓度小的都与需配制的浓度相减,以对角线把绝对值写上,得出的数右上角20是应取浓度大的(85%)体积数,在右下角的25是应取浓度小的(40%)体积数。
即以浓度大的取20单位体积,浓度小的取25单位体积混合均匀,就是我们要配制的第三种(60%)浓度。
2)稀释法
这种方法是用于由浓度大稀释成浓度小的溶液。如,已有浓度大的y%(假设水溶液)的溶液,要稀释成x%的溶液。其方法是,从y%的溶液中取出x毫升,用蒸馏水冲稀到y毫升,即为x%的浓度。
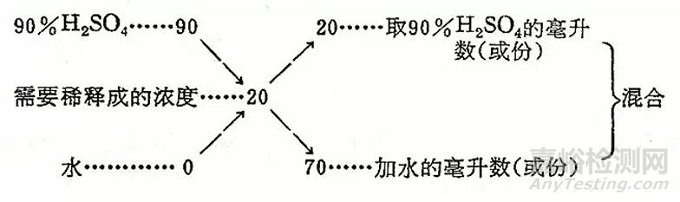
例如:已有90%的硫酸,要稀释制备20%的硫酸。即从90%的硫酸中取出20毫升,加水(注意!应先将硫酸加到少量水中)冲稀到90毫升,即为20%的硫酸。
这个方法的道理是来自混合法,只不过将第二个稀浓度的数值换成“0”而已。上例用混合法验证一下,如下图式所示:
混合法和稀释法所配制的体积数都是比较小的(不超过100毫升),如果所需量大一些,而且是要一定体积数,就需再计算一下所取份的倍数。
例如:已有95%的酒精,要稀释到25%,而且需要475毫升,其计算方法应为:
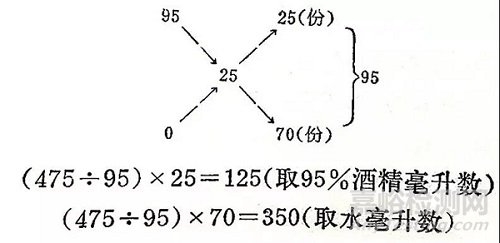
即:从95%酒精中取125毫升,加水350毫升混合,即为25%酒精475毫升。

来源:Internet


