您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-08-20 12:46
▲NMPA发布《第一类医疗器械产品目录》修订草案(征求意见稿)(图源:NMPA)
为深化医疗器械审评审批制度改革,进一步指导第一类医疗器械备案工作,助推医疗器械产业高质量发展,国家药监局组织起草了《第一类医疗器械产品目录》修订草案(征求意见稿)(以下简称“《I类器械目录》”)和修订说明,并于8月18日正式对外发布。
《第一类医疗器械产品禁止添加成分名录》
值得关注的是,这是NMPA首次对提出《I类器械目录》,在《I类器械目录》中也首次明确和强调《第一类医疗器械产品禁止添加成分名录》(以下简称“《名录》”),以更好的指导第一类医疗器械备案工作。
《名录》明确,第一类医疗器械产品目录中“06-08-01超声耦合剂” “09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“14-10-08液体、膏状敷料”中的产品不能含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学或者代谢作用成分或可被人体吸收的成分,包括但不限于下表1所列成分。备案时在产品组成项下应明确写明相关产品的具体组成成分,不可使用类似“所含成分不具有药理学作用。所含成分不可被人体吸收”或类似笼统描述。
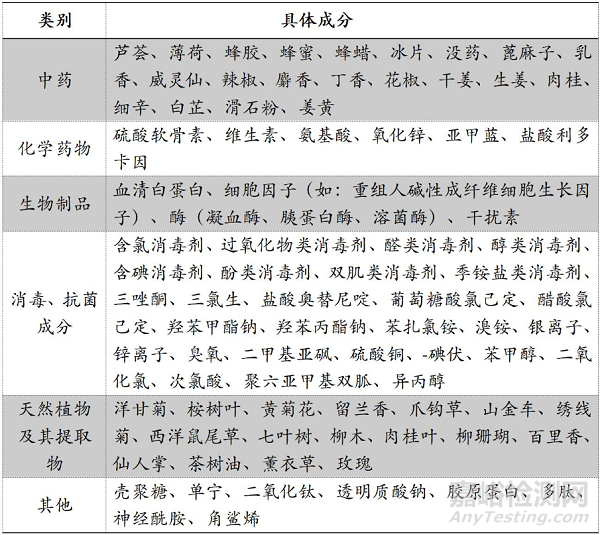
▲NMPA发布《第一类医疗器械产品禁止添加成分名录》(图源:NMPA)
众所周知,境内第一类医疗器械备案工作系由设区的市级药品监督管理部门负责。由于各地监管水平差异,第一类医疗器械备案工作尺度也存在不同。
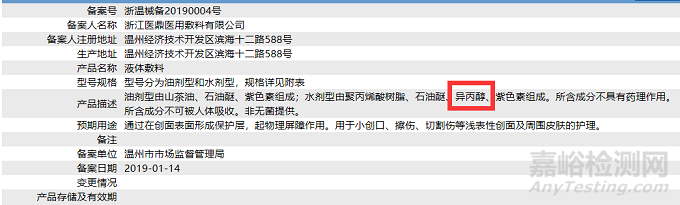
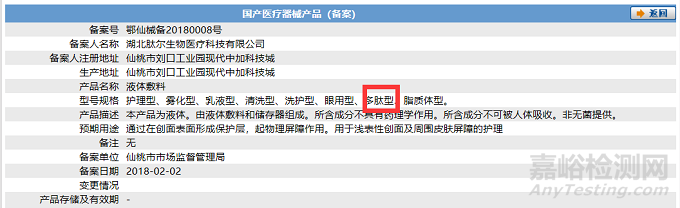
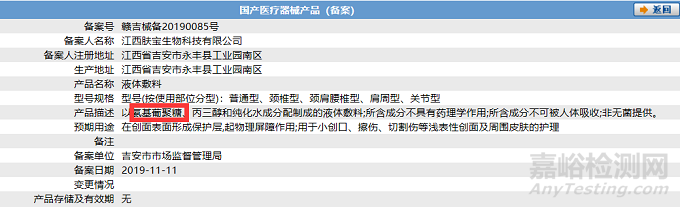
其中,争议和影响较大的就是,《第一类医疗器械产品禁止添加成分名录》中的相关组分普遍存在于已上市的“14-10-02创口贴”“14-10-08液体、膏状敷料”。不置可否,上述要求如若正式实施,对I类敷料的影响无疑将是十分深远的,望相关企业务必关注。

来源:NMPA


