罕见病通常发病率/患病率极低,多为慢性、遗传性疾病,常常危及生命。欧美国家认识到保障罕见病患者用药可及性的重要性,出台了罕见病用药(也称孤儿药)相关法律法规及制度,通过明确孤儿药认定标准,给予经过认定的孤儿药一系列研发、生产、上市后激励政策,保障孤儿药可及性。其中,市场独占制度是国际通行的激励孤儿药研发上市的重要策略,是为了保障罕见病患者能公平地获得健康权而采取的政策倾斜。
独占(exclusivity)指在药品上市保护期,根据法规规定,延迟或者禁止竞争药品上市。与专利相比,在性质上,独占是药品监督管理部门提供的一种行政保护,专利是专利行政部门在药品开发过程中授予的财产权[1]在保护期限上,独占通常从药品上市之日开始计算,专利可以随时颁发或到期,与药物的批准状态无关,二者可以同时或不同时运行[2]。独占涉及针对创新药的数据保护(数据独占),以及针对孤儿药、完成儿科研究计划品种的市场独占[3,4]。理论上,数据保护仅针对申请人自行取得、未公开披露的试验数据,并不禁止仿制药企业自行开展临床试验获取数据;市场独占不涉及试验数据保护。但在数据保护下,仿制药企业不会选择自行开展临床试验,数据保护和市场独占往往能达到相似的市场独占效果。
2002年,我国《药品管理法实施条例》提到对获得生产或者销售含有新型化学成份药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据实施保护,保护期6年,但该项制度一直未得到有效落实。2017年,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出,完善和落实药品试验保护。2018年,国家药品监督管理局(以下简称国家药监局)就《药品试验数据保护实施办法(暂行)》公开征求意见,提出给予罕见病治疗药品数据保护期范围。2022年,《药品管理法实施条例(征求意见稿)》首次提及对罕见病新药给予最长不超过7年的市场独占期,对儿童用药给予最长不超过12个月的市场独占期,其间不再批准相同品种上市。市场独占制度对激励企业开展相关领域药品研发具有重要作用。美国和欧盟的市场独占制度运行已有较长时间,积累了丰富的经验,本文试图对其进行剖析,为我国制定罕见病用药市场独占制度提供参考和借鉴。
1、 美国孤儿药市场独占制度
1.1 美国孤儿药市场独占相关规定
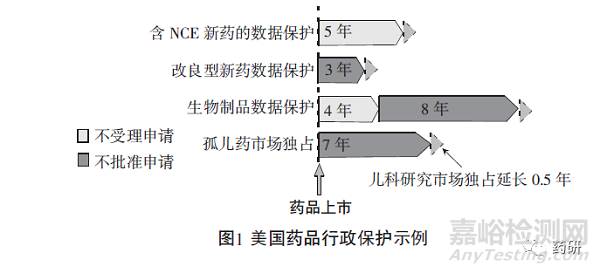
为鼓励罕见病用药研发,美国于1983年颁布了《孤儿药法案》(Orphan Drug Act,ODA),明确了罕见病及孤儿药的定义、市场独占等内容。1984年,罕见病标准修订为“在美国患病人数不超过20万人的疾病,或者患病人数超过20万人但治疗药物在美国的销售额无法补偿其研发成本的疾病”。用于预防、诊断、治疗罕见病的药物即孤儿药。药物在获得孤儿药资格认定后,可以享受7年市场独占、申请费用减免等激励政策。《孤儿药法案》的出台为世界罕见病用药政策制定奠定了基础[6]。
依据《孤儿药法案》,获得孤儿药认定的药物在上市申请获批时,FDA若尚未批准过相同药物用于相同用途或适应症,则在上市之日起7年内不会再批准其他相同药物用于相同用途或适应症,除非下列情形出现:FDA撤回已上市孤儿药的市场独占权或撤销其孤儿药身份;因任何原因撤回有关药物的上市申请;已上市孤儿药持有人同意;已上市孤儿药持有人未能确保该药的供应。如果已有相同药物用于相同用途或适应症,后续药物若能证明相比已上市药物更具临床优势,则不视为“相同药物”,可作为孤儿药获批上市并享受相关优惠政策。
市场独占权是针对适应症的市场保护,如果已存在针对该适应症的孤儿药,FDA可以批准该药用于其他用途或适应症;若相同药物的另一用途或适应症获得孤儿药资格认定,FDA也可以授予其新的市场独占权;已上市药品的新适应症被认定为孤儿药,也可获得新的独占期。
1.2 孤儿药市场独占的关键要素
1.2.1 相同药物
相同药物主要从药物结构与药物用途两方面界定。其中,小分子药物结构主要考虑“活性部分”(active moiety)的范围,常规新药批准中通常使用“活性成分”(activeingredient)的概念,二者有所不同。活性部分是指主要发挥生理/药理作用的分子或离子,不包括药物其他分子附加部分。活性成分是指提供药理活性或其他直接作用,或影响人体或其他动物身体的结构或任何功能的任何成分,包括药物生产过程可能经历化学变化并以提供指定活性或效果的改良形式存在于药品中的组分。相较“活性成分”,“活性部分”的范围更狭窄,但依照其定义,药物活性成分的变化若不影响发挥生理/药理作用的活性部分,二者会被视为相同药物。在美国,《关于修订<联邦食品、药品和化妆品法>的法案》授权FDA在判断新药是否享有独占权等活动中使用“活性部分”的概念。
《孤儿药法案》颁布之初,仅制定了小分子药物与大分子药物的“相同药物”界定标准,小分子药物在“相同药物”界定中考虑药物活性部分与用途两个方面;大分子药物因其结构复杂,被分为蛋白质、多糖、多核苷酸药物与其他四类,含有相同的主要分子结构特征并用作相同用途,也被视为“相同药物”,并不要求新申请药物含有已上市药物的所有结构特征,微小的结构差异也在市场独占的保护范围内。随着基因技术的发展,2021年FDA发布了《解读<孤儿药法案>中的基因治疗产品的相同性》指南,明确了用于相同适应症的基因治疗产品的相同性界定原则[7],将转基因与载体等某些关键特征视为药物的“主要分子结构特征”,同样将药物结构的微小差异纳入了市场独占的保护范围。
1.2.2 临床优势
临床优势是指相较已批准药物,新申请药物在一个或多个方面存在显著治疗优势。在美国,若能证明临床优势,新申请药物便不会被视为“相同药物”,可作为孤儿药获批上市,并享受相应的政策优惠。例如,2022年治疗慢性髓细胞性白血病(CML)的孤儿药Dasynoc被批准上市,在其之前已有相同药物治疗相同适应症,但Dasynoc在CML人群同时使用抗酸剂的情况下仍可被吸收(其他同类药物可能需要胃酸才能被吸收),符合在其他方面对患者护理作出了重大贡献(Major Contribution to Patient Care,MC toPC)标准,获得了7年市场独占期[8]。
总的来说,FDA主要从有效性、安全性对患者护理的重大贡献三方面考察药物的临床优势。(1)相比已上市的药物具有更好的有效性。(2)消除与相对频繁的不良反应相关的成分或污染物,提高了大部分目标人群的安全性。(3)未显示更好的有效性或安全性的情况下,证明药物在其他方面对患者护理作出了重大贡献。在适用于严重或危及生命的疾病时,MC to PC通常考虑方便的治疗地点、治疗持续时间、患者舒适度、较长的给药间隔等因素,不考虑药物的治疗成本与依从性[9]。
2、 欧盟孤儿药市场独占制度
2.1 欧盟孤儿药市场独占相关规定
欧盟《孤儿药法规》(EC No 141/2000)确定了孤儿药认定标准与市场独占、费用减免等优惠政策,如孤儿药可以享受费用减免、市场独占等政策激励。欧盟孤儿药认定标准:用于诊断或预防严重威胁生命、慢性削弱性疾病,且患病人数不超过万分之五;或没有激励措施的情况下,药物的税后收益不足以弥补研发投入。此外,若对某适应症已存在相应药品或治疗方法,则新申请上市的孤儿药应证明其具有显著收益。
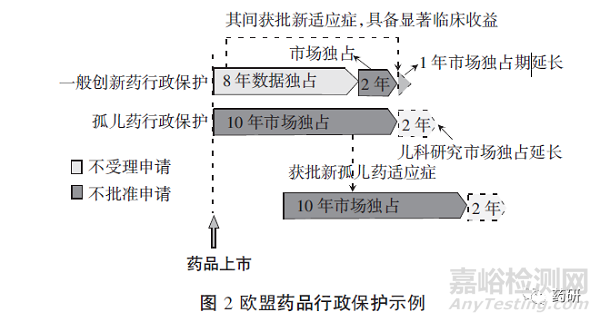
在儿科研究方面,根据法规EC No 1901/2006,非孤儿药完成儿科研究并符合相关规定,或因适应症只影响成人等原因被豁免儿科研究,无论该药最终是否可以用于儿童,都可获得6个月的补充保护证书(SPC)用于延长专利;对孤儿药,完成儿科研究,并将研究结果反映在相关文件、包装中或被豁免儿科研究,可以获得两年的独占期延长(见图2)。
《孤儿药法规》指出,获得孤儿药认定的药物上市后,在不损害知识产权法或其他欧盟法律等的情况下,欧盟及成员国10年内不得针对相同适应症的相同药物,接受、批准或延长另一上市申请,除非出现下列情形:原孤儿药持有人同意;原孤儿药持有人无法提供足够数量的药品;后续申请人可以在上市申请中证明产品在安全性、有效性或其他方面具有临床优势。同时,如果在第五年底,该孤儿药不再符合上述认定标准,尤其是现有证据证明该孤儿药已获得足够的利润,没有理由继续维持市场独占时,其市场独占期可缩短为6年[10]。不同于一般创新药新增适应症并具有显著临床收益时增加1年市场独占期,孤儿药新增适应症时,新适应症将开启另一个“10+2”市场独占。对孤儿药,“10+2”市场独占与“8+2+1”的常规保护同时运行,二者并行不悖[12]。
2.2 孤儿药市场独占的关键要素
2.2.1 相同药物
2018年,欧盟通过实施条例(EU)2018/781完善了“相同药物”的定义。“相同药物”是指含有与已上市的孤儿药中一种或多种相似活性物质的医药产品,并用于相同的适应症。其中,“相似活性物质”(similar active substance)可以是相同活性物质,也可以是具有相同主要分子结构特征和作用机制的活性物质,与美国一样,用途相同的药物即便在结构上具有微小差异,欧盟也视为“相同药物”。
2.2.2 临床优势
与美国孤儿药规定相近,欧盟根据实施条例(EC)No 847/2000,“临床优势”是指在有效性、安全性或对患者护理的重大贡献方面优于已上市的孤儿药。
3、 美国和欧盟孤儿药市场独占制度比较
3.1 共性及差异之处
《孤儿药法案》与《孤儿药法规》颁布以来,欧美孤儿药认定与上市数量激增。1983—2020年,美国认定5 769个孤儿药适应症,其中1 039个成功上市[12];2000—2020年,欧盟对2 282个适应症药物授予了孤儿药身份,最终220个上市[13]。《孤儿药法案》作为世界罕见病用药政策的基础,被视为有效卫生政策的典范[14],市场独占被认为是其中最强有力的激励政策。美国与欧盟的罕见病用药市场独占制度核心都是通过额外的市场利润激励制药企业研发,并明确界定了“相同药物”及“临床优势”。前者主要考虑药物结构与用途;后者主要考虑药品安全性、有效性或对患者护理的重大贡献。但二者期限不同,美国的罕见病用药+完成儿科研究能够获得7+0.5年的市场独占,欧盟可以获得10+2年;同时,欧盟在第五年底设置了评估流程,试图将获得足够利润的罕见病用药市场独占期收缩至6年。
3.2 存在的问题
3.2.1 相同适应症的界定存在争议
尽管欧美国家已围绕罕见病用药市场独占制定并完善了“相同药物”“临床优势”等关键要素的界定标准,但仍有新的争议出现,例如对“相同适应症”覆盖范围的争议。美国巡回法院将其解读为疾病整体,但目前仍存在争议,《孤儿药法案》可能会进一步修订,将市场独占限制在“经批准的用途或适应症”范围内。
3.2.2 市场独占保护作用减弱
市场独占制度制定之初,为难以获得专利保护的生物制品提供了有力的行政保护[15],但随着专利制度的完善与生物制品数据保护制度的颁布,市场独占的保护作用相对减弱。有研究指出,1985—1994年,美国仅有57%的孤儿药拥有专利,50%的孤儿药市场独占期超过专利期;1995—2004年,这两个数字变为67%与35%;到2005—2014年,87%的孤儿药拥有专利,仅18%的孤儿药市场独占期超过专利期。可见,专利对孤儿药的保护越来越全面,市场独占期超过专利期的孤儿药比例越来越低,对孤儿药市场竞争的保护作用越来越弱[15]。
3.2.3 定期评估条款无法发挥作用
孤儿药认定是针对药物特定适应症的资格认定,同一药物可通过不同适应症获得多个孤儿药认定与市场独占,这种模式使一种药物获取超额利润成为可能。对此,欧盟试图以定期评估的方式平衡企业利益和公众利益,但收效甚微。一是虽然法规指出在第5年底对孤儿药进行评估,但实际仅评估通过“收入不足以弥补研发成本”这一路径获得认定的孤儿药,而非将所有孤儿药纳入评估范围。二是“足够的利润”这一概念未有明确的界定[16]。
4、 启示
我国于2022年颁布《药品管理法实施条例(征求意见稿)》(以下简称《条例》),首次提及市场独占期:对首个批准上市的儿童专用新品种、剂型和规格,及增加儿童适应症或用法用量的,给予最长不超过12个月的市场独占期;对批准上市的罕见病新药,在药品上市许可有人承诺保障药品供应情况下,给予最长不超过7年的市场独占期,期间不再批准相同品种上市,药品上市许可持有人不履行供应保障承诺的,终止市场独占期。对此,结合欧美国家市场独占制度规定及其实施经验,本文提出以下思考与建议。
4.1 明确罕见病用药市场独占适用范围
《条例》将罕见病用药的市场独占保护范围限制在“罕见病新药”,根据2015年《国务院关于改革药品医疗器械审评审批制度的意见》,“新药”指“未在中国境内外上市销售的药品”,即“全球新”;根据物质基础的原创性和新颖性,又分为创新药和改良型新药[17]。在欧美国家,孤儿药认定资格并未与药品注册分类“绑定”,更强调在本国市场中尚未有相同药物用于某适应症。目前,我国孤儿药自主研制市场几近空白,主要依赖进口[18]。罕见病用药市场独占的适用范围若依照“全球新”,一是对引入国外已上市药物无法起到激励作用;二是专利已过期的“老药”若无行政保护作为补偿,不会选择进入中国市场;三是“新药”的范围无法鼓励我国企业对已过专利期的药物进行仿制。因此,需结合我国罕见病用药国情,明确罕见病用药市场独占的适用范围,尽快提升罕见病用药的可及性。
4.2 明晰儿科用药市场独占性质
罕见病用药的市场独占是一种初始独占,即从药品上市之日起计算;儿科用药的市场独占时间较短,是一种附加独占,用于延长其他市场独占或专利,且不要求研究结果为阳性,即只要符合相关儿科研究计划,即使最终该药不可用于儿童,也可以享有儿科用药市场独占。我国《条例》要求药品可以用于儿童,对企业而言,开展儿科临床研究的风险更大,但最高12个月的儿童用药市场独占性质不明确,若与专利或其他市场独占并行,则激励效果有限。罕见病大多发病于儿童期[19],我国应鼓励罕见病用药儿科研究,以满足儿童患者的临床需求。在两种市场独占并行的情况下,儿童用药市场独占失去了意义,尤其是当开展儿科用药研究成本高、风险高的情形下,在成人用药基础上进行超说明书用药,可能对制药企业更有利。因此,应明确儿童用药市场独期能否与罕见病用药市场独占期“串联”运作。
4.3 确定市场独占中关键要素的概念及界定标准
第一,明确“相同品种”的定义。《条例》指出,市场独占期期间,不再批准“相同品种”上市,但需进一步明确“相同品种”这一概念。例如美国以分子的“活性部分”界定小分子药物市场独占的“相同药物”,替换了“活性成分”概念,灵活地收缩了界定范围,扩大了孤儿药市场独占的保护范围;同时欧美都以法规中的定义部分或出台条例的形式对“相同药物”作了详细规定。
第二,充分考虑“相同适应症”要素。无论是市场独占制度的核心内容,还是“相同药物”的界定,欧美国家均强调“适应症”这一要素。市场独占制度的本质是在独占期期间,给予特定适应症的市场保护。相同品种药品用于其他适应症的上市申请,乃至另一市场独占权的授予,都不应受已上市品种市场独占期的限制。
第三,制定“临床优势”相关标准。罕见病用药激励政策的初衷是通过额外的经济利润激励制药企业研发,提高罕见病用药可及性。因此,当新申请药物满足“相同品种”界定标准时,不应直接因市场独占而拒绝批准其上市申请,而是应由后续申请人自证其药品相比已批准药品更具临床优势。“临床优势”概念可借鉴欧美国家的成熟经验,考虑药品安全性、有效性或对患者护理的重大贡献,同时对相关数据的获取方式作出要求。