今日头条
深圳微芯HDAC抑制剂报产。微芯生物口服HDAC抑制剂西达本胺联合R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、强的松)用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤(DLBCL)患者的上市申请获CDE受理。今年3月,西达本胺在III期临床(DEB试验)中达到预设的疗效与安全性指标,独立数据监查委员会(IDMC)建议申办者提前递交附条件上市申请。
国内药讯
1.复星MEK1/2抑制剂拟纳入突破性疗法。复星医药1类化药FCN-159片获CDE拟纳入突破性疗法,用于治疗无法手术或术后残留/复发的NF1相关的丛状神经纤维瘤成人患者。FCN-159是一款MEK1/2选择性抑制剂,拟开发的适应症包括晚期实体瘤、神经纤维瘤、组织细胞肿瘤、动静脉畸形等。此前,该产品用于治疗组织细胞肿瘤适应症已被纳入突破性疗法认定。
2.泰它西普治疗干燥综合征Ⅱ期临床见刊。荣昌生物在期刊RHEUMATOLOGY在线发表BLyS/APRIL双靶点融合蛋白泰它西普治疗原发性干燥综合征的Ⅱ期临床积极结果。24周时,安慰剂组、160mg组与240mg组ESSDAI评分较基线变化的平均值分别为0.6±4.55,–3.3±2.73,–1.3±4.14。按照安慰剂调整最小二乘法,160mg组ESSDAI评分较基线变化值为-4.3,P值为0.002。治疗组未发生死亡或严重不良事件(SAE)。
3.百奥泰CTLA4单抗获批实体瘤临床。百奥泰自主研发的经无岩藻糖基化优化的CTLA-4单抗BAT4706获国家药监局临床试验默示许可,拟联合PD-1抗体BAT1308注射液开展用于治疗晚期实体瘤患者的临床研究。在I期剂量爬坡研究中,BAT4706单药已显示出良好的安全性及约70%的疾病控制率。CTLA-4单抗单药或联合用药在多种实体瘤治疗中均有良好的抗肿瘤作用。
4.曙方引进DMD新药获批临床。Santhera公司与曙方医药合作开发的1类化药vamorolone口服混悬液获国家药监局临床许可,拟用于治疗2岁及以上患者的杜氏肌营养不良(DMD)。Vamorolone是一款创新类固醇药物,此前已获得FDA授予治疗DMD的孤儿药资格、快速通道资格与罕见儿科疾病认定(PRDD)。目前,该新药的上市申请正接受FDA的监管审查,PDUFA日期预定为今年10月26日。
5.信立泰自免病小分子新药美国获批临床。信立泰自主研发的口服小分子免疫抑制剂SAL0119片获FDA批准,将在美国开展用于治疗类风湿关节炎、强直性脊柱炎、银屑病关节炎的临床研究。SAL0119具有不同于JAK类的作用机制和广谱的细胞因子抑制作用。该新药目前正在国内开展I期临床,评估用于活动性强直性脊柱炎及中重度活动性类风湿关节炎的安全性与有效性。
6.迈威两款ADC疗法获批临床。迈威生物两款1类生物药9MW2921和7MW3711分别获得CDE临床许可。其中9MW2921是一款靶向Trop-2的抗体偶联药物(ADC),7MW3711是一款靶向B7-H3的ADC产品,两款新药均通过与肿瘤细胞表面的抗原结合进入肿瘤细胞,通过特定酶解作用,定向释放小分子,从而实现对肿瘤的精准杀伤。两款新药拟开发适应症均为晚期实体瘤。
7.重庆精准CD19-CAR-T报IND。重庆精准生物1类生物制品MC-1-50细胞制剂的临床试验申请获CDE受理。MC-1-50是该公司基于其PrimeCARTM平台开发的一款靶向CD19的CAR-T疗法。公布于ASCO2023年会上的MC-1-50治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)的初步数据显示,13例患者接受MC-1-50输注,有3例患者出现CRS;在所有剂量水平上都观察到CAR-T扩增;在DL2下,2例患者出现PR反应,5例患者中有3例出现CR反应。在DL3下,5例患者中的5例达到CR反应。
国际药讯
1.AZ/赛诺菲长效RSV抗体美国获批上市。阿斯利康与赛诺菲开发的长效呼吸道合胞病毒(RSV)抗体Beyfortus(Nirsevimab)获FDA批准上市,用于新生儿在第一个RSV感染季预防婴幼儿RSV引起的下呼吸道疾病(LRTD)。临床汇总数据显示,与安慰剂相比,nirsevimab降低足月出生或早产婴儿因RSV感染需要治疗的下呼吸道感染风险79.5%(p<0.0001)。去年11月,该新药已在欧盟获得全球首批,商品名为Beyfortus。
2.THR-β激动剂报NASH上市申请。Madrigal公司宣布已完成向FDA滚动提交“first-in-class”口服选择性甲状腺激素受体(THR)-β激动剂resmetirom的优先审评新药申请(NDA),用于治疗伴肝纤维化的非酒精性脂肪性肝炎(NASH)患者。在Ⅲ期临床(MAESTRO-NASH)中,与安慰剂相比,resmetirom(80mg和100mg)治疗达到非酒精性脂肪肝活动评分(NAS)降低≥2分,且肝纤维化无恶化的患者比例更多(26%和30%,vs10%)。2023年4月,该新药已被FDA授予突破性疗法认定。
3.口服TTR稳定剂III期临床积极。BridgeBio公司新一代转甲状腺素蛋白(TTR)小分子稳定剂acoramidis在治疗伴有心肌病的转甲状腺素蛋白介导的(ATTR)淀粉样变性(ATTR-CM)患者的Ⅲ期临床达到主要终点。按全因死亡率、心血管相关住院频率、NT-proBNP较基线变化和6分钟步行距离较基线变化的优先顺序层级分析,Win比率(Win ratio)达到1.8(p<0.0001),acoramidis组与安慰剂组生存率分别为81%和74%。该公司预计在今年年底向FDA递交新药申请(NDA)。
4.礼来Aβ单抗Ⅲ期临床积极。礼来宣布将在AAIC2023年会上公布Aβ单抗donanemab治疗早期症状性阿尔茨海默病(AD)的Ⅲ期临床TRAILBLAZER-ALZ 2完整结果。该研究已达到主要和所有关键次要终点,donanemab在低-中等tau组患者中显著减缓其iADRS与CDR-SB指标下降达35%与36%;在所有淀粉样蛋白阳性的早期症状性AD患者中显著减缓其iADRS与CDR-SB下降达22%与29%。新的亚群分析显示,处于疾病最早阶段的轻度认知障碍患者中,donanemab显著减缓其iADRS下降达60%。
5.FcRn拮抗剂治疗CIDP临床积极。Argenx公司全球首款FcRn拮抗剂艾加莫德的皮下注射制剂(VYVGART Hytrulo)在治疗慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的ADHERE研究达到主要终点 (p=0.000039)。与安慰剂相比,VYVGART® Hytrulo可降低复发风险61%(HR: 0.39 95% CI: 0.25; 0.61),且药物安全性良好。VYVGART Hytrulo是由FcRn拮抗剂VYVGART®和重组人透明质酸酶PH20(rHuPH20)共同配制。再鼎医药拥有VYVGART和VYVGART Hytrulo在大中华区的开发和商业化授权。
6.创新RNAi疗法AD早期临床积极。Alnylam公司RNAi疗法ALN-APP用于治疗阿尔茨海默病(AD)和脑淀粉样血管病(CAA)的Ⅰ期临床中期结果积极。数据显示,75 mg ALN-APP单剂量鞘内注射给药可使患者脑脊液(CSF)中可溶性APPα(sAPPα)和可溶性APPβ(sAPPβ)的最大降幅分别达到84%和90%;平均降幅分别大于55%和65%。ALN-APP总体耐受性良好,所有不良事件的严重程度均为轻中度。详细结果将公布AAIC2023年会上。
医药热点
1.国家出台指导意见推动临床专科能力建设。国家卫健委发布《关于推动临床专科能力建设的指导意见》提出,到2025年末,进一步夯实基础专科和平台专科的能力基础,在部分发病率高且严重危害人民群众健康的重大疾病的专病诊疗模式和学科组织形式上有创新性突破,建设一批特色临床专科,为患者提供一站式、全流程诊疗服务。《指导意见》围绕行政部门、医疗机构主体、临床专科建设管理三大方面提出了13条具体措施。
2.全国医院大检查启动。7月15日,国家医保局网站正式发布《关于开展2023年医疗保障基金飞行检查工作的通知》。《工作方案》明确,今年检查对象为定点医疗机构、定点零售药店、医保经办机构;检查重点为医学影像检查、临床检查、康复三个领域。医保飞检工作采取“省份交叉互检”模式,通过抽签方式确定参检和被检省份。飞行检查实行组长负责制,原则上每组检查人数控制在60人以内,检查时间控制在10天以内。
3.上海市五官科医院上线云候诊服务。复旦大学附属眼耳鼻喉科医院正式首发上线基于候诊场景的智慧服务——云候诊(候诊大厅)。无论是科室、专家、检验检查、出入院办理和取药等候诊信息统统汇总到全新云候诊。通过多端协同,通过移动端即可了解候诊现场全信息,实现大屏、小屏和移动端的候诊信息线上线下联动,在任何一个地方看着手机都会有身处在在诊室门口候诊一样的体验。
评审动态
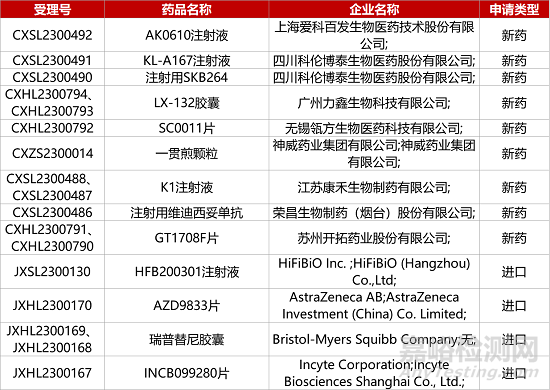
1. CDE新药受理情况(07月18日)
2. FDA新药获批情况(北美07月14日)