今日头条
恒瑞PARP抑制剂报妇科肿瘤NDA。恒瑞PARP抑制剂氟唑帕利胶囊新适应症的上市申请获CDE受理,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者一线含铂化疗后的维持治疗。在III期临床(NCT04229615)中,氟唑帕利单药的维持治疗可显著延长这类患者的无进展生存期。该新药此前已获批用于既往二线及以上化疗的伴有胚系BRCA突变的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌的治疗,以及铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。
国内药讯
1.诺华长效降脂siRNA疗法中国获批上市。诺华靶向PCSK9的小干扰核酸(siRNA)疗法英克司兰钠注射液(乐可为,inclisiran)获国家药监局批准上市,作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合性血脂异常患者的治疗。一项ORION-3试验结果显示,在他汀基础上,每年两次inclisiran治疗可在4年内有效持续降低LDL-C水平;约80%的患者LDL-C水平达到<70mg/dL。
2.泰它西普治疗RA的Ⅲ期临床积极。荣昌生物BLyS/APRIL双靶点融合蛋白注射用泰它西普(RC18,商品名:泰爱®)在中国治疗类风湿关节炎(RA)患者的Ⅲ期临床达到主要终点。与甲氨蝶呤单药相比,泰它西普(160mg)联合甲氨蝶呤治疗第24周时显著提高患者ACR20应答率。详细结果将发表于学术期刊和学术会议上。预计近期将向CDE递交新药上市申请。
3.齐鲁创新PROTAC获批实体瘤临床。齐鲁制药1类化药QLH12016胶囊获国家药监局临床默示许可,拟用于治疗包含晚期前列腺癌在内的恶性实体瘤。QLH12016是一款具差异化分子设计的PROTAC(靶向蛋白降解嵌合体)产品,已在临床前研究中显示出积极的体内外肿瘤抑制效应,并具备成药性特征。该新药有望为转移性去势抵抗性前列腺癌(mCRPC)患者提供新的治疗选择。
4.苏州澳宗改良型依达拉奉获批ALS临床。苏州澳宗生物依达拉奉改良型新药TTYP01片获FDA临床许可,即将在美国开展用于治疗肌萎缩侧索硬化症(ALS,俗称渐冻人症)的临床研究。澳宗生物通过特有的专利技术改变给药途径,将依达拉奉注射剂改良成口服的片剂,可为患者提供长达一年以上的持续治疗。此前,该新药已获得FDA授予用于治疗ALS的孤儿药资格。
5.北京呈诺iPSC来源细胞药物报IND。北京呈诺医学1类生物制品异体内皮祖细胞(EPCs)注射液ALF202的临床试验申请获CDE受理。这是一款基于诱导多能干细胞(iPSC)定向诱导分化得到的EPCs治疗产品,拟开发用于远端肢体缺血的治疗。EPCs是血管内皮前体细胞,广泛参与缺血组织的血管发生和血管后损伤。2022年4月,该公司首个产品ALF201注射液(受理号:CXSL2200090)已获批开展用于治疗大动脉粥样硬化型急性缺血性卒中的临床试验。
国际药讯
1.安进KRAS抑制剂获FDA支持批准。安进KRAS抑制剂Lumakras(sotorasib)获FDA肿瘤学药物咨询委员会(ODAC)支持,推荐由加速批准转变为完全批准,治疗经治、KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)。预计FDA将在今年12月24日之前做出审评结果。在确证性Ⅲ期临床CodeBreaK 200中,与标准化疗相比,Lumakras将患者疾病进展或死亡风险降低34%(HR:0.66,[95% CI:0.51,0.86];P=0.002)。
2.FIC端粒酶抑制剂向FDA报产。Geron公司端粒酶抑制剂GRN163L(Imetelstat)的新药申请获FDA受理,用于治疗低危骨髓增生异常综合征(LR-MDS)患者的输血依赖性贫血。Imetelstat旨在结合并抑制端粒酶,从而调控恶性造血干细胞的凋亡。在一项II/III期研究(IMerge)中,与安慰剂相比,imetelstat治疗第8周时显著提高不需要输血的患者比例(39.8%vs15.0%;P<0.001)。
3.礼来RET抑制剂甲状腺髓样癌III期临床成功。礼来制药RET抑制剂塞普替尼(selpercatinib)治疗初治、RET突变型晚期或转移性甲状腺髓样癌(MTC)的III期LIBRETTO-531研究达到主要终点。与卡博替尼或凡德他尼对照药物相比,selpercatinib一线治疗显著延长患者无进展生存期(PFS)。2020年5月,selpercatinib已被FDA加速批准上市,是首款针对RET基因融合阳性癌症(包括非小细胞肺癌(NSCLC)、髓样甲状腺癌(MTC)和甲状腺癌)的精准疗法。
4.Geneos公司癌症疫苗早期临床积极。Geneos公司基于DNA质粒递送的个体化癌症疫苗与PD-1抑制剂Keytruda联用,在二线治疗晚期肝细胞癌(HCC)的Ⅰb/Ⅱa期临床获积极结果。根据RECIST1.1,在32例可评估患者中,3例获得完全缓解,7例获得部分缓解,9例患者疾病稳定。根据RECIST1.1或ctDNA检测,32例可评估患者中,11例获得完全缓解,部分缓解,或者完全分子生物学缓解。临床中未发现严重疫苗相关不良事件。
5.阿斯利康Claudin18.2/CD3双抗上Ⅰ/Ⅱ期临床。阿斯利康Claudin18.2/CD3双抗药物AZD5863(HBM7022)在Clinicaltrials.gov网站上登记注册一项国际Ⅰ/Ⅱ期临床,计划在美国、中国、荷兰、韩国、日本入组200例晚期实体瘤患者,评估AZD5863的安全性、耐受性和药代动力学特征,以及初步疗效。预计2026年底完成。HBM7022最初由和铂医药开发,阿斯利康拥有该新药的全球权益。
6.FDA部分暂停吉利德CD47单抗临床试验。吉利德潜在“first-in-class”CD47单抗药物Magrolimab用于治疗急性髓系白血病(AML)的临床研究已被FDA叫停。该项试验不再招募新的患者入组。Magrolimab的主要作用机制是阻断CD47-信号调节蛋白(SIRPα)之间的抑制性相互作用,增强巨噬细胞和其他吞噬细胞识别和消灭外来细胞和恶性细胞的能力,从而达到阻断癌细胞发出的“别吃我”信号的目的。
医药热点
1.全国居民健康素养水平达27.78%。近日,国家卫健委官网发布2022年中国居民健康素养监测情况。健康素养是指个人获取和理解基本健康信息和服务,并运用这些信息和服务做出正确决策,以维护和促进自身健康的能力。监测结果显示,2022年我国居民健康素养水平达到27.78%,比2021年提高2.38%;其中,城市居民健康素养水平为31.94%,农村居民为23.78%,较2021年分别增长1.24%和1.76%。
2.北京重大呼吸道传染病研究中心成立。8月20日,北京重大呼吸道传染病研究中心在北京正式成立。该研究中心依托北京市疾病预防控制中心(北京市预防医学科学院),联合首都医科大学附属北京地坛医院、佑安医院、朝阳医院、胸科医院,以及中国科学院病原微生物与免疫学重点实验室、中国医学科学院和中日友好医院、昌平实验室等单位相关研究团队,成立并开展相关研究,旨在提升北京市重大呼吸道传染病防控能力。
3.猪肾人体移植创纪录。8月16日,美国纽约大学兰贡医疗中心发布公报表示,该中心的一个研究团队将基因编辑猪的肾脏移植到一名已脑死亡但维持生理机能的57岁男性受试者体内,猪肾脏已正常工作32天,创造了基因编辑猪肾脏在人体内工作的新纪录。目前这个猪肾脏仍在正常工作中。据悉,这次试验还将进行一个月。
评审动态
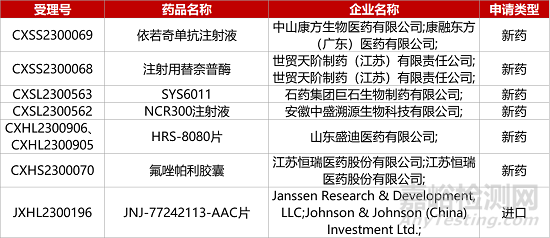
1. CDE新药受理情况(08月23日)
2. FDA新药获批情况(北美08月22日)