今日头条
信达OX40L单抗获批皮炎临床。信达生物靶向OX40L的新型免疫调节剂IBI356获国家药监局临床默示许可,拟开发用于治疗特应性皮炎。OX40L(也被称为CD252)是一种II型糖蛋白,是OX40的配体,与其结合后可形成T细胞共刺激物,促进T细胞活化并延长其活化时间,进而增加IL-4、IFN-γ等细胞因子的表达。研究表明,阻断OX40与OX40L之间的相互作用具有治疗自身免疫性疾病的潜力。
国内药讯
1.阿斯利康PD-L1抗体中国获批新适应症。阿斯利康PD-L1抑制剂度伐利尤单抗(英飞凡,Imfinzi)获国家药监局批准新适应症,推测本次获批适应症为“胆道癌(BTC)”。在Ⅲ期临床TOPAZ-1中,该新药联合化疗较化疗显著提高患者总生存期(中位OS:12.8个月vs11.5个月)和无进展生存期(中位PFS:7.2个月vs5.7个月),使死亡风险降低20%。此前,该疗法已获批用于一线治疗广泛期小细胞肺癌(ES-SCLC),和非小细胞肺癌(NSCLC)。
2.礼来Aβ单抗中国纳入拟优先审评。礼来Aβ单抗Donanemab注射液获CDE拟纳入优先审评,用于治疗早期阿尔茨海默病(AD)。今年年初,CDE已将该新药纳入突破性治疗品种。在Ⅲ期TRAILBLAZER-ALZ 2研究中,donanemab治疗组患者的iADRS评分和CDR-SB评分的下降速度分别减缓35%和36%,疾病进展速度延缓40%。在美国,礼来已向FDA递交Donanemab的上市申请,以寻求加速批准。
3.曙方引进DMD新药拟纳入突破性治疗品种。曙方医药与Santhera公司联合开发的创新类固醇药物vamorolone口服混悬液获CDE拟纳入突破性治疗品种。值得一提的是,今年9月,CDE已将该新药纳入突破性治疗品种,用于治疗杜氏肌营养不良(DMD)患者。在IIb期临床(VISION-DMD)中,vamorolone的疗效与强的松相比达到非劣效标准。FDA已在上个月批准vamorolone上市,用于治疗2岁及以上DMD患者。
4.辉瑞整合素αvβ8拮抗剂中国获批临床。辉瑞1类生物制品PF-06940434注射液获国家药监局临床试验默示许可,拟用于静脉注射给药治疗晚期或转移性实体瘤患者。PF-06940434是一款整合素αvβ8拮抗剂,通过抑制TGFβ的活化,进而消除免疫抑制,增强抗肿瘤免疫。目前,该新药正在I期临床中评估单药以及与PD-1联用治疗实体瘤的安全性与初步疗效。
5.广州费米子Nav1.8抑制剂授权健康元。健康元药业与广州费米子科技公司就后者Nav1.8(电压门控钠离子通道1.8)抑制剂FZ008-145签署一项合作许可协议,获得FZ008-145在大中华区的独家权益。FZ008-145具有优效、非成瘾性镇痛的优势。今年10月,FZ008-145已向CDE递交IND申请。费米子科技是一家AI驱动的小分子药物研发公司,该公司首款产品非成瘾性慢性镇痛候选药物FZ002已在今年3月进入I期临床。
国际药讯
1.PPARα/δ双重激动剂肝病Ⅲ期临床积极。Ipsen与GENFIT联合开发的PPARα/PPARδ双重激动剂elafibranor治疗原发性胆汁性肝硬化(PBC)的Ⅲ期ELATIVE试验结果公布于AASLD年会并发表在《新英格兰医学杂志》上。与安慰剂相比,elafibranor(80mg)组第52周时达到生化应答的患者比例显著更高(51%vs4%,P<0.001);该组有15%(vs0%)的患者达到ALP正常值;药物耐受性良好。2019年,FDA已授予elafibranor突破性疗法认定。
2.诺和诺德减肥复方启动头对头Ⅲ期研究。诺和诺德双重作用机制复方CagriSema在Clinicaltrials.gov网站上注册一项Ⅲ期临床,计划入组800例肥胖或超重患者,评估Cagrilintide 2.4mg s.c.联合Semaglutide 2.4 mg s.c. (CagriSema s.c. 2.4mg/2.4mg) 每周一次给药与Tirzepatide 15mg s.c.每周一次对比,在临床一年半期间用于减肥的有效性和安全性。CagriSema由长效胰淀素类似物cagrilintide和GLP-1受体激动剂司美格鲁肽组成。
3.眼科基因疗法获再生医学先进疗法认定。Atsena公司基因疗法ATSN-101获FDA授予再生医学先进疗法(RMAT)认定,用于治疗由GUCY2D双等位基因突变引起的Leber先天性黑蒙(LCA1)患者。在Ⅰ/Ⅱ期试验中,ATSN-101视网膜下给药6个月后,患者研究眼最佳矫正视力(BCVA)改善大于0.3 log MAR,而未接受过治疗眼睛的BCVA则出现下降;ATSN-101耐受性良好,没有出现与药物相关的严重不良事件。
4.安进CCR8抗体上Ⅰ期临床。安进CCR8抗体药物AMG 355在Clinicaltrials.gov网站上注册一项Ⅰ期临床。这是AMG 355药物首次人体试验,拟评估AMG 355单药治疗和与PD-1抑制剂Keytruda(pembrolizumab)联合治疗晚期实体瘤患者的安全性、耐受性、药代动力学和有效性。AMG 355可能采用去岩藻糖设计,提高ADCC活性等。安进在2022年递交了CCR8抗体的专利申请。
5.阿斯利康PD-L1单抗肺癌III期临床失败。阿斯利康PD-L1抑制剂Imfinzi(度伐利尤单抗)联合铂类放化疗(CRT)治疗不可切除非小细胞肺癌(NSCLC)的III期PACIFIC-2研究未达到主要终点。与单独使用CRT治疗相比,度伐利尤单抗与CRT同时使用未能显著改善患者无进展生存期(PFS)。此外,联合治疗期间观察到感染率增加。
6.Jazz公司7.7亿美元开发小分子调节剂。Jazz Pharmaceuticals与Autifony公司将利用后者专有离子通道药物发现平台,合作开发靶向与神经障碍相关的两个不同离子通道靶点的候选药物。根据协议,Autifony将负责两个靶点的药物发现和临床前开发活动。Autifony将获得预付款,两个项目的开发、监管和商业里程碑后期付款,项目总金额高达7.71亿美元。Jazz将负责所有临床开发、生产和监管以及商业化活动。
医药热点
1.辉瑞在英国裁员500人。11月14日,辉瑞宣布停止位于英国肯特郡的桑威奇的制药科学小分子 (PSSM) 部门的运营,裁员约500人。这次裁员计划是作为其上月公布的全球成本削减计划的一部分,辉瑞将2023年的收入预期下调了90亿美元,并表示将在全球范围内开展成本削减活动。10月31日,辉瑞公布2023年三季报,前三季度公司实现营收442.47亿美元,同比下降42%;净利润54.88亿美元,同比下降79%。
2.上海市第十人民医院领导班子调整。11月13日,上海申康医院发展中心党委在上海市第十人民医院召开干部会议,宣布申康中心党委关于上海市第十人民医院领导职务任免决定:沈兵同志任上海市第十人民医院党委副书记、院长,李颖川同志任医院党委副书记(主持工作),不再担任副院长。范理宏同志不再担任医院党委书记,秦环龙同志不再担任党委副书记、院长。
3.我国出台癌症防治行动实施方案。近日,国家卫健委、国家发改委等13个部门发布了《健康中国行动—癌症防治行动实施方案(2023—2030年)》。《实施方案》提出的主要目标是:到2030年,癌症防治体系进一步完善,危险因素综合防控、癌症筛查和早诊早治能力显著增强,规范诊疗水平稳步提升,癌症发病率、死亡率上升趋势得到遏制,总体癌症5年生存率达到46.6%,患者疾病负担得到有效控制。
评审动态
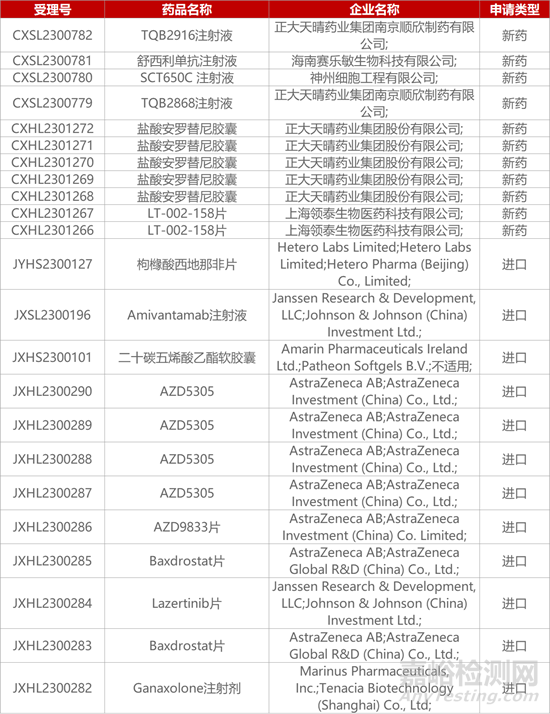
1. CDE新药受理情况(11月15日)
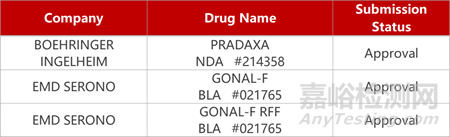
2. FDA新药获批情况(北美11月14日)