今日头条
来凯FIC减肥抗体获批IND。来凯医药潜在“first-in-class”ActRIIA单抗LAE102获FDA临床许可,拟用于治疗肥胖症患者。LAE102针对参与调控肌肉再生和脂代谢的新靶点ActRIIA,对肿瘤生长、免疫激活、肌肉再生和造血发育等都有调控作用。去年5月,该新药已获FDA批准开展用于治疗非小细胞肺癌等实体瘤的I/II期临床。在国内,该新药用于晚期/转移性实体瘤的适应症也获批临床许可。
国内药讯
1.梯瓦偏头痛新药III期临床成功。梯瓦CGRP抑制剂瑞玛奈珠单抗(Fremanezumab)用于中国成年患者偏头痛预防性治疗的III期研究达到了主要终点和所有次要终点。与安慰剂相比,Fremanezumab治疗使患者每月偏头痛天数显著减少;且药物耐受性良好,未出现任何安全信号;详细结果将在医学会议上公布。在美国和欧盟,Fremanezumab已获批用于成年患者偏头痛的预防性治疗。
2.君圣泰代谢调节剂启动Ⅲ期临床。君圣泰生物肝-肠抗炎代谢调节剂HTD1801在Clinicaltrials.gov网站上注册两项Ⅲ期临床,拟评估用于治疗2型糖尿病的有效性与安全性。HTD1801是该公司首发管线,包含小檗碱和熊去氧胆酸有效成分,拟开发用于非酒精性脂肪性肝炎(NASH)、2型糖尿病、高血脂、胆管炎等多个适应症。在Ⅱa期临床中,与安慰剂相比,HTD1801(1000mg)显著减少了患者18周后的肝脏脂肪含量。
3.辉大RNA编辑疗法获儿科RPDD。FDA授予辉大基因公司迷你型dCas13X-RNA碱基编辑器(mxABE)疗法儿科罕见病药物资格(RPDD),用于治疗OTOF(otoferlin)基因中Q829X突变相关的儿童听力损失。这是一种先天性耳聋,由OTOF基因突变导致表达的耳铁蛋白(otoferlin)功能失常,从而影响声音刺激信号由耳朵传向大脑。此前,该产品已获FDA授予孤儿药资格。
4.深圳莱芒CAR-T早期临床积极。深圳莱芒生物代谢增强型CD19 CAR-T产品在 AACR 2024年会上公布了一项研究者发起、用于治疗复发难治性晚期CD19阳性血液瘤患者的临床试验(IIT)的积极结果。该临床试验首批入组了包括罹患弥漫大B细胞淋巴瘤(DLBCL)和B细胞急性淋巴细胞白血病(B-ALL)共12例晚期患者,接受极低的给药剂量治疗后,全部患者均获得完全缓解(CR),并且患者仅经历轻微的细胞因子风暴(CRS)。
5.元宋溶瘤病毒获批IND。元宋生物溶瘤病毒产品YSCH-01(重组L-IFN腺病毒注射液)获CDE批准开展临床试验,用于治疗晚期实体瘤(包括但不限于头颈部鳞癌、卵巢癌、非小细胞肺癌等)。YSCH-01利用具有靶向肿瘤双重调控的溶瘤腺病毒载体携带了多功能抗癌的重组免疫抗癌基因L-IFN,已在临床前多个实体肿瘤研究中显示出90-100%的抑瘤效果。此前,该新药已获FDA批准开展新药研究。
6.丹码中美双报单抗获批IND。丹码生物1类生物制品DM919注射液获国家药监局批准开展I期试验,拟评估用于治疗晚期实体瘤的安全性与有效性。DM919是该公司首个管线研发产品,是一款MIC A/B单抗。MIC A/B在癌变、感染、DNA损伤等应激反应中显著上调,进而激活表达NKG2D的NK细胞、CD8+T细胞来清除表达MICA/B的肿瘤细胞等。去年年底,该新药已获得FDA临床批件。
国际药讯
1.新型眼科基因疗法获批Ⅲ期临床。Ocugen公司宣布其新型基因疗法OCU400的Ⅲ期临床IND补充件已获得FDA批准,即将开展评估用于治疗色素性视网膜炎(RP)患者的有效性与安全性,且无需考虑RP患者的基因突变类型。该疗法采用AAV载体,将核激素受体基因NR2E3的功能性拷贝递送至视网膜中的靶细胞,有助于重置视网膜稳态,具有稳定细胞和挽救光感受器变性的潜力。在欧盟,OCU400已获得用于治疗RP和Leber先天性黑矇(LCA)的孤儿药资格。
2.Geneos公司癌症疫苗见刊。Geneos公司基于质粒编码至多40个肿瘤新抗原的个性化癌症疫苗GNOS-PV02与PD-1抑制剂派姆单抗联合治疗晚期肝细胞癌(HCC)的Ⅰ/Ⅱ期临床成果发表于Nature Medicine期刊上。数据显示,GNOS-PV02联合治疗在36例经治患者中达到了30.6%的客观缓解率,包括3例患者完全缓解和8例患者部分缓解。GNOS-PV02联合治疗较派姆单抗单药治疗提高了患者的临床缓解(30.6%vs16.9%),且药物安全性良好。
3.Obsidian公司TIL疗法早期临床积极。Obsidian公司自体肿瘤浸润淋巴细胞(TIL)疗法OBX-115治疗黑色素瘤患者的首个人体临床结果积极。OBX-115通过基因工程改造表达与细胞膜结合的IL-15,旨在提高TIL细胞疗法的抗癌活性和安全性。数据显示,OBX-115治疗12周后达到了50%的客观缓解率(ORR)和33%的完全缓解率;疾病控制率(DCR)为100%;6个月时的无进展生存率为67%。此外,药物安全性良好。
4.Tr1X公司T细胞疗法获批临床。FDA批准Tr1X公司同种异体调节性T细胞疗法TRX103开展首个人体临床试验,用于预防HLA不匹配的造血干细胞移植患者的移植物抗宿主病。这是该公司首个现货型调节性T细胞疗法,拟开发用于治疗多种自身免疫和炎症性疾病。该公司还计划在2024年第三季度提交TRX103治疗难治性克罗恩病的IND。
5.Century公司布局自免病领域管线。Century公司宣布以4500万美元总交易金额收购Clade公司,并获得其iPSC来源的NK细胞疗法及平台,增强其在癌症和自身免疫性疾病领域的应用。Century同时也完成6000万美元融资,以支持其靶向CD19的诱导自然杀伤细胞(iNK)疗法CNTY-101开展治疗系统性红斑狼疮(SLE)的相关临床试验(CALiPSO-1)。目前,CNTY-101也正在临床试验(ELiPSE-1)中评估用于治疗B细胞恶性肿瘤的潜力。
6.富士胶片旗下CDMO公司增资扩厂。富士胶片旗下CDMO公司Fujifilm Diosynth 计划在20亿美元基础上再增资12亿美元,以进一步扩建位于北卡罗来纳州(North Carolina)霍利斯普林斯的大型生物制造工厂。该工厂将于2025年正式运营,新投资将使其基地20,000升哺乳动物细胞培养生物反应器总数达到16个,增加了大规模生产能力。预计到2031年,这项投资将新增680个工作岗位。
医药热点
1.北京:每个街道至少建设1个养老服务中心。4月10日,《北京市街道(乡镇)区域养老服务中心建设管理指引(试行)》发布,要求每个街道(乡镇)原则上至少建设1个养老服务中心,建筑面积原则上不少于2000平方米,应包括托养服务区、社区餐厅、老年学堂、医养服务区和综合服务区等功能分区。其中,托养服务区床位不少于10张,护理型床位占比原则上不低于60%,具备条件的可设置失智照护专区;医养服务区内部可设置诊所、卫生所(室)、医务室、护理站或引入医疗机构。
2.百济神州广州生物药生产基地ADC园区启用。近日,百济神州广州生物药生产基地抗体偶联药物(ADC)生产园区竣工启用,旨在依托广州和大湾区的政策支持和产业资源,加速创新药物的研发、生产和商业化进程,打造生物医药全产业链卓越中心。该园区占地5.8万平方米,建设有两个主要生产车间,前期已建成包括抗体偶联、超滤纯化和无菌灌装冻干在内的生产线,并配备了ADC专用的QC分析实验室,以及MST和工艺开发实验室,以全面支持技术转移和商业化生产。
3.阿斯利康CEO 2024薪酬2370万美元。路透社报道:阿斯利康股东批准了2024年的薪酬政策,其中首席执行官(CEO)Pascal Soriot 2024薪酬提高12%至1890万英镑(约2370万美元)。Soriot 2023年薪酬为1685.3万英镑(约2103万美元),主要由于他在创新、股东回报和环境可持续发展等领域的表现挂钩的长期激励。2023年阿斯利康全年营收458亿美元,完成了450亿美元的预期目标。阿斯利康已成为英国第二大市值上市公司,目前市值为2134.3亿美元。
评审动态
1. CDE新药受理情况(04月13日)
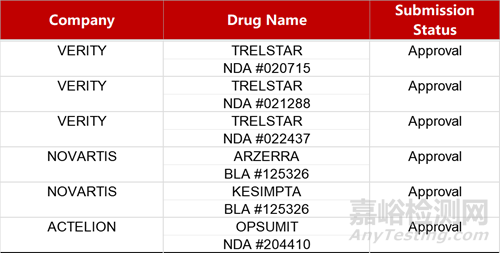
2. FDA新药获批情况(北美04月12日)