您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-08-07 21:29
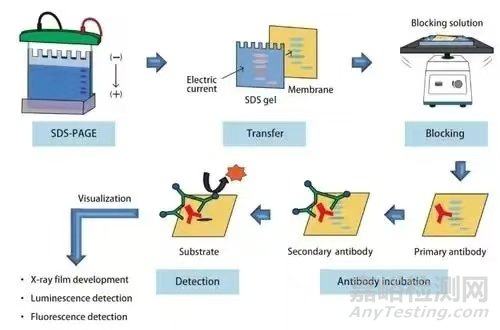
蛋白质免疫印迹法是基于蛋白质SDS-PAGE电泳分离和特异性抗体识别蛋白的特性,通过显色技术,以达到检测目的蛋白的技术。该技术广泛应用于定性检测蛋白水平的表达,活性分析与鉴定。
该实验步骤多,关键点多,耗时长,每个步骤可能都影响最终的结果,所以实验中经常出现各种问题。笔者根据个人实际实验操作中遇到的问题将从WB的配胶和电泳阶段分析问题原因或给出解决方法。
一、配胶阶段注意事项
配胶试剂管理:
应确保所使用的配胶试剂在有效期内,且试剂需清澈透明。若发现有沉淀或结晶产生,应及时进行更换。
2. pH 8.8的Tris-HCl和pH 6.8的Tris-HCl可能会出现沉淀,因此需根据需要选择合适的浓度(1.0M或1.5M)。同时,10%的SDS在低温(4℃以下)存放时容易结晶,而30%的丙烯酰胺则需要在避光且低温(4℃以下)的条件下保存。
APS(过硫酸铵)活性较强,室温下容易失效,建议进行分装后冷冻保存于-20℃。由于TEMED(四甲基乙二胺)挥发性强且有毒,因此需要在通风条件良好的环境下使用,避免长时间直接暴露在空气中。
操作技巧:
1. 在插入梳子时,应采用斜插的方式,以有效避免气泡的产生。
2. 为了防止胶条老化和干燥,电泳结束后,应将胶条置于实验台上晾干。如果胶条出现裂纹,可以使用保鲜膜进行覆盖,这样不仅可以防止胶液泄漏,还能延缓胶条的老化。
3. 最佳的操作方法是现配现用胶。如果需要保存,可以使用湿润的保鲜膜将胶包好,并放置在4℃的冰箱中。
常见问题分析:
1.漏胶问题:
原因分析:漏胶通常由于玻璃板未对齐、底部缺损、厚玻璃板边条密闭性不佳或塑料夹子过松所导致。
解决方法:在操作前,务必确保玻璃板干燥,以防潮湿影响对齐。在对齐玻璃板时,应使用一手的食指按压厚玻璃板的一侧上缘,同时用拇指按压薄玻璃板的同侧上缘,然后同时向下按压并锁定该侧的锁扣。接着,重复此步骤以锁定另一侧,确保玻璃板紧密对齐。
2.胶体未凝固:
原因分析:胶体未能凝固可能是由于APS或TEMED失效,或者在胶体未完全凝固时对其进行了移动。
解决方法:在制备胶体前,确认所有试剂的有效性,并严格按照正确的配比进行混合。如果配比无误但胶体仍未凝固,可以尝试增加凝固剂的用量或延长凝固时间。
3.胶体中存在气泡:
情况一:胶底部出现气泡,可能是胶垫材质或梳子插入不当所致。可改用实心软胶垫或添加保鲜膜。
情况二:梳子下缘出现气泡,解决方法是先插入一侧梳子再插另一侧。
4.拔梳子后泳道有胶丝:
原因分析:此问题通常是由于TEMED用量过多,导致胶体凝固过快。
解决方法:在制备胶体时,适当减少TEMED的用量。
5.拔梳子后泳道歪斜:
原因分析:泳道歪斜往往是由于梳子与玻璃板不匹配所致。
解决方法:在灌胶之前,务必先测试梳子与玻璃板的匹配度,确保它们能够紧密贴合。
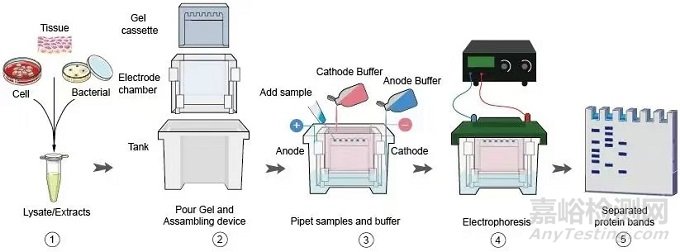
二、电泳阶段注意事项
电泳操作要点:
1.确保上样一致性:
在进行上样时,必须确保每个加样孔的上样体积保持一致,这样可以避免蛋白条带出现水平不齐的情况。对于空置的加样孔,需要添加与样品等体积的1×loading buffer,以防止相邻通道的蛋白样品发生扩散。同时,上样时应缓慢添加样品,避免快速吹打导致样品溢出,且上样体积应控制在加样孔总容积之内。
2.电泳液的使用:
内槽需要被电泳液填满,而外槽则只需填至1/4处。对于不同厚度的玻璃板,上样量也有所不同。例如,1.0mm厚的玻璃板每孔最多可以上样20μL,而1.5mm厚的玻璃板每孔则可以上样40μL。
3.合理设置电压:
电压的设置需要根据环境温度来调整。在夏季室温较高时,应适当降低电压;而在冬季则可以提高电压。分离胶的固定电压应设为150V。在调节电压时间时,可以参考marker的位置。当marker分开时,表示蛋白已经进入分离胶。此外,在夏季高温时,可以将电泳槽放入冰水中进行降温,以防止凝胶发生变形。
4.常见问题分析:
1)电泳带扭曲或歪斜:
原因分析:这种情况通常是由于电泳液未加足够或发生漏液所导致。
解决方法:在电泳过程中,要及时检查和补充电泳液,以确保电泳槽内的液体保持足够的量,从而逐渐纠正电泳带的走向。
2)电泳带出现拖尾现象:
原因分析:拖尾现象往往是因为样本未能充分溶解。
解决方法:在进行上样前,务必确保样本已经完全溶解,这样可以有效减少拖尾现象的发生。
3)电泳带向两侧过度扩散:
原因分析:扩散过度通常是由于上样量过多所引起。
解决方法:应当适当减少上样量,以控制电泳带的扩散范围,保持电泳带的清晰度。
4)溴酚蓝呈笑脸状:
原因分析:当制胶试剂温度过高或制胶后未能及时保湿时,可能导致胶层不均匀,从而使得溴酚蓝呈现特殊的笑脸形状。
解决方法:在进行电泳时,应降低电压并调节电泳速度,同时确保电泳过程在冰浴条件下进行,以减少胶层不均匀的情况。
5)电泳条带不整齐:
原因分析:条带不整齐可能由于胶凝固不均匀、胶的下边缘存在气泡、上样buffer浓度不准确或在拔梳子时操作不当所导致。
解决方法:应等待胶完全凝固后再进行上样,以确保实验结果的最佳性;电泳前需仔细检查并清除胶底部的气泡;重新配置适宜浓度的上样buffer;在拔梳子时,应水平且缓慢地进行,以确保样品孔的均匀性。
6)电泳条带过粗:
原因分析:条带过粗可能是由于上样量过大、浓缩胶未能有效浓缩、浓缩胶的pH值不准确或电压过高所导致。
解决方法:应适量减少上样量;考虑增加浓缩胶的长度以提高浓缩效果;确保浓缩胶的pH值调整至正确的6.8;同时,适当降低电泳的电压。
通过严格遵守上述电泳阶段的注意事项,并不断优化实验流程,可以有效提升Western Blot实验的成功率,并确保实验数据的准确性和可靠性。

来源:Internet


