您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-18 18:41
一、基本概况
1、自然环境
俄罗斯横跨欧亚大陆,东西最长9000公里,南北最宽4000公里,国土面积1709.82万平方公里。邻国西北面有挪威、芬兰,西面有爱沙尼亚、拉脱维亚、立陶宛、波兰、白俄罗斯,西南面是乌克兰,南面有格鲁吉亚、阿塞拜疆、哈萨克斯坦,东南面有中国、蒙古和朝鲜。东面与日本和美国隔海相望。大部分地区处于北温带,以大陆性气候为主,温差普遍较大,1月气温平均为-40~-5℃,7月气温平均为11~27℃。
2、人口和行政区划
俄罗斯人口有1.46亿人,民族194个,其中俄罗斯族占77.7%,主要少数民族有鞑靼、乌克兰、巴什基尔、楚瓦什、车臣、亚美尼亚、阿瓦尔、摩尔多瓦、哈萨克、阿塞拜疆、白俄罗斯等。官方语言为俄语。
根据俄罗斯宪法,俄罗斯联邦现由85个平等的联邦主体组成,其中包括22个共和国、9个边疆区、46个州、2个联邦直辖市、1个自治州和4个民族自治区。首都为莫斯科(Moscow, Москва),面积约为2560平方公里。
3、2024年出口概况
中俄经贸合作态势良好,2024年1-10月,中国向俄罗斯出口医疗器械总计约109.90亿元人民币,同比上升1.86%。
二、俄罗斯医疗器械监管机构和法规要求
俄罗斯的医疗器械监管机构为俄罗斯联邦卫生监督局(Federal Service for Surveillance in Healthcare, Roszdravnadzor, 或简称RZN)。RZN是俄罗斯联邦卫生部下属的医疗器械注册与控制部门(Medical Device Registration and Control Department),负责医疗器械注册、变更的审批,并对获批产品发放证书。同属于RZN的国家质量机构FGBU负责对产品的质量管控。
获得俄罗斯医疗器械注册证有两个路径:
(1)俄罗斯国家法规医疗器械注册路径,过渡期截止至2025年12月31日。在俄罗斯国家法规注册路径中,俄罗斯境内及境外医疗器械都必须向RZN提起注册申请,RZN审核通过后,颁发注册证书。该路径需要遵循法规:
◆ Article 38 of the Health Law (Federal Law 323)
◆ Order No. 1416 Medical Device Registration Rules
(2)欧亚经济联盟(EAEU)注册路径,当前可以申请,按照当前法规,这是2026年1月1日后的唯一注册路径。但鉴于2025年3月1日,俄罗斯将继续对法规进行修订,RZN注册路径的延期有效时间犹未可知。
三、医疗器械定义
根据GOST 31508-2012和《俄罗斯联邦第323-ФЗ号联邦法》(《公民健康保护法》),医疗器械的定义如下:由制造商单独生产或联合使用,用于疾病诊断、预防、监控、治疗或康复,或用于人体解剖学或生理学研究和代偿,包括医疗仪器、设备、工具、材料、仪器套件或其他物品。
特点:
◆ 非药物:医疗器械主要通过物理手段发挥作用,而非药物或化学成分。
◆ 预期用途:根据设计,用于医疗、外科、牙科、护理或诊断等功能。
◆ 包括配件:必要时,定义中还包括了辅助设备、消耗品或软件。
四、产品分类
1、分类依据:
《关于医疗器械命名分类的批准》 附录二(MINISTRY OF HEALTH OF THE RUSSIAN FEDERATION, ORDER dated 06 June 2012 No. 4n “ON APPROVAL OF THE NOMENCLATURE CLASSIFICATION OF MEDICAL DEVICES” Appendix 2)
2、分类
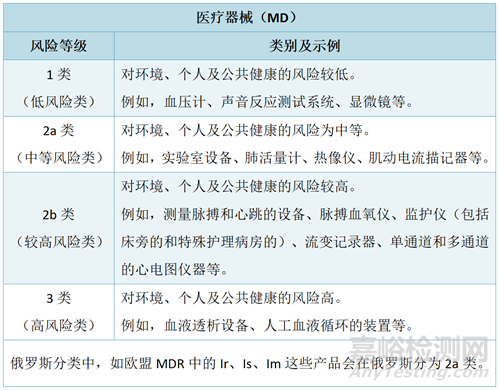
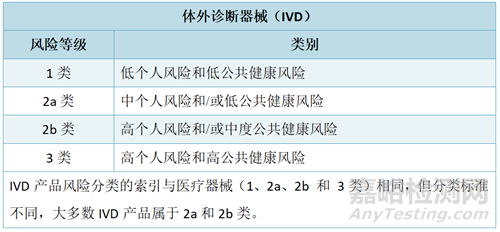
俄罗斯医疗器械的分类方式与欧盟相似,根据风险程度将医疗器械(MD)和体外诊断器械(IVD)各分为四类。
五、俄罗斯国家法规注册流程
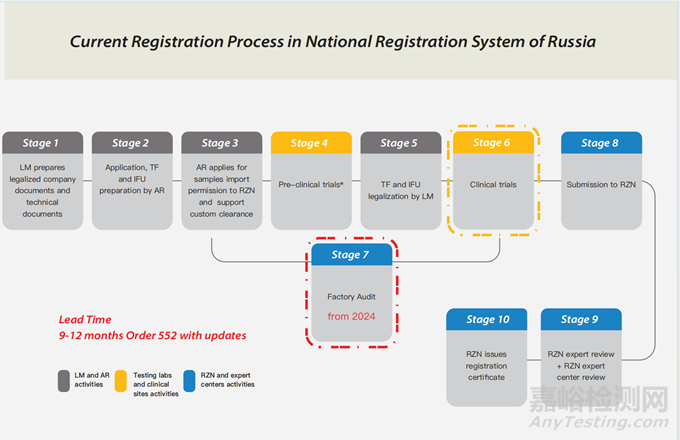
1、注册流程解读
2、注册提交技术文件(以俄文撰写提供)

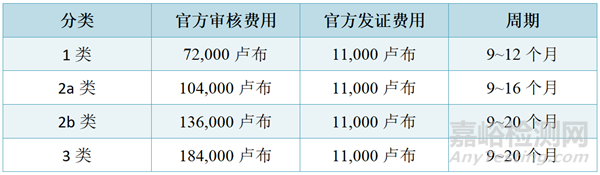
3、注册周期及费用
在医疗器械的国家注册期间,对医疗器械的质量、有效性和安全性进行专家检查(取决于其使用的潜在风险类别,根据负责制定和实施医疗保健领域国家政策和法律法规的联邦执行机构批准的医疗器械命名分类):
注册变更费用:
1、更改医疗器械注册档案中包含的不需要对医疗器械的质量、有效性和安全性进行专家审查的文件:2,500 卢布;
2、在修改注册档案中包含的文件时,对医疗器械的质量、有效性和安全性进行专家审查(取决于其使用的潜在风险类别,根据负责制定和实施医疗保健领域国家政策和法律法规的联邦执行机构批准的医疗器械命名分类)医疗设备:
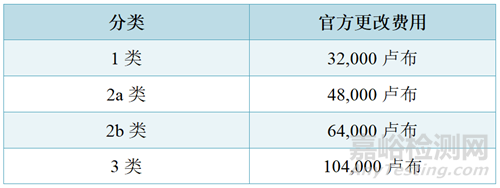
有关费用的更多详情请见俄罗斯联邦税收法典第333.32.2条规定。
4、注册提交流程
由俄罗斯授权代表,在俄罗斯联邦卫生监管局(Federal Service for Surveillance in Healthcare, Roszdravnadzor)网站提交注册申请。
5、现场审核要求及注意事项(质量体系要求)
俄罗斯医疗器械生产企业需要满足生产质量管理体系标准GOST ISO 13485:2017,等同于ISO 13485:2016,但企业还需要满足俄罗斯医疗器械法律法规的要求。
俄罗斯医疗器械生产质量管理体系主要依据的法规有:
Order No.135 of the Government of the Russian Federation dated 09/02/2022 (as amended on 29/12/2022)
自2024年起,对于2a类灭菌、2b类、3类产品,在RZN注册时需要由RZN进行现场生产质量管理体系审核。1类及2a类非无菌产品的医疗器械生产企业,需要实施和维护生产质量管理体系,但现场审核并非强制需要进行。体系审核的内容包括但不限于:质量方针、质量手册、产品全生命周期的风险管理、来料检验、成品检验、过程检验、设计开发、生产、最终控制相关的流程方法。
6、该区域有关UDI的要求
无特殊要求
此外,2024年11月30日,俄罗斯联邦政府发布关于医疗器械注册规则的第1684号法令,实施后将取代现有的注册程序。1684号法令将于2025年3月1日正式实施,学会将积极安排有关新法令的解读,敬请期待!

来源:广东医疗器械学会


