您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-17 09:52
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
博唯生物国产9价HPV疫苗启动III期临床。博唯生物科技登记启动其重组人乳头瘤病毒(6/11/16/18/31/33/45/52/58型)九价疫苗(汉逊酵母)的III期临床试验,以评价HPV九价疫苗接种于20-45岁中国女性人群的保护效力,同时评价HPV九价疫苗接种于20-45岁中国女性的免疫原性和安全性。该研究计划在国内入组8000例20-45岁的女性,分别接受HPV九价和四价疫苗的治疗。目前,国内的九价HPV疫苗仅有默沙东一家获批上市。
1.辅仁药业多潘立酮片通过一致性评价。辅仁药业多潘立酮片获国家药监局批准通过一致性评价,成为该品种继维奥制药之后,第2家通过一致性评价的企业。多潘立酮片是一种多巴胺受体拮抗剂,属于胃肠解痉药及胃动力药,被广泛用于治疗恶心和呕吐。该药原研药由杨森研发,最早于1980年在法国获批上市。1989年该品的原研地产化产品(西安杨森)在中国获批上市,规格为10mg,商品名为吗丁啉。
2.荣昌生物红斑狼疮新药获FDA快速通道资格。荣昌生物BLyS/APRIL双效抑制剂泰它西普(RC18,telitacicept)获FDA授予快速通道资格。泰它西普是一款TACI-Fc融合蛋白,具有全新的药物结构和双靶点作用机制,拟用于治疗系统性红斑狼疮。在一项II期临床中,泰它西普高剂量治疗组48周狼疮应答指数(SRI-4)显著高于安慰剂对照组,到达主要终点。血清指标等次要终点结果与有效性结果相符,而且泰它西普耐受性良好。
3.信达生物PD-1单抗获第3个孤儿药资格。信达生物宣布其PD-1抑制剂达伯舒(信迪利单抗)获FDA授予治疗食管癌的孤儿药资格。这也是该单抗获得的第3个孤儿药资格。早前,信迪利单抗已分别获得EMA和FDA授予的孤儿药资格,对应的适应症分别为外周T细胞淋巴瘤、T细胞淋巴瘤。据悉,达伯舒2018年12月获NMPA批准用于治疗复发/难治性经典型霍奇金淋巴瘤,2019年3月成功上市销售,上市不到一年的时间就创造了10.159亿元的销售收入,是中国上市第一年最畅销的产品之一。
4.康宁杰瑞双特异性抗体KN046美国II期临床即将启动。江苏康宁杰瑞自主研发的全球首创重组人源化PD-L1/CTLA-4双特异性抗体KN046获FDA批准,即将启动治疗PD-(L)1难治/复发性非小细胞肺癌的Ⅱ期临床研究。据悉,KN046是目前全球唯一处于临床开发阶段的PD-L1/CTLA-4双特异性抗体,已在澳大利亚和中国同步开展的Ⅰ期临床中显示出较好的安全性和初步疗效,目前正在中国开展非小细胞肺癌、三阴性乳腺癌、食管鳞癌、胰腺癌等多项Ⅱ期临床试验。
5.红日药业PD-L1 登记启动I期临床。4月13日,红日药业在ClinicalTrials.gov上登记启动其PD-L1药物艾姆地芬 (IMMH-010 )治疗晚期恶性实体瘤的I期临床试验。该研究由广东省人民医院吴一龙教授担任主要研究者,计划入组96例恶性实体瘤患者,评估艾姆地芬60、120、240、360mg治疗恶性实体瘤的安全性和耐受性,确定艾姆地芬的最大耐受剂量和II期推荐剂量,同时评估食物对晚期实体瘤患者的药代动力学影响。
6.PD-1+溶瘤病毒联合疗法国内获批临床。滨会生物重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞)获国家药监局临床试验默示许可,联合翰中生物PD-1(HX008 注射液)用于治疗不可手术切除、标准治疗失败的晚期实体瘤。OH2注射液目前处于II期临床开发阶段,2020年以来,该新药又先后获批多项临床试验,用于联合PD-L1或PD-1治疗实体瘤。滨会生物表示将率先在国内启动OH2注射液与Keytruda、HX008和LP002(厚德奥科,PD-L1)联合用药的3项I期临床试验。
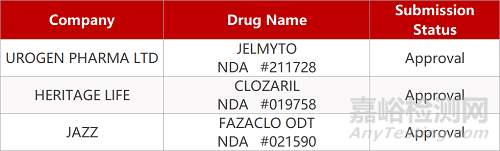
1.首个低级别上尿路上皮癌药物获FDA批准。FDA批准UroGen Pharma公司开发的烷基化药物Jelmyto(丝裂霉素凝胶)上市,治疗低级别上尿路上皮癌(UTUC)。这也是FDA批准针对这一特定患者群的首款疗法。在一项临床中,Jelmyto在71例低级别UTUC患者中的完全缓解率达到58%(41例);而且在开始治疗后的一年内,19例(46%)获得完全缓解的患者在12个月时继续获得完全缓解。此前FDA已授予Jelmyto快速通道资格、孤儿药资格、优先审评资格和突破性疗法认定。
2.FDA授予两款抗体检测系统紧急使用授权。FDA授予Ortho Clinical Diagnostics公司的COVID-19全抗体检测试剂盒紧急使用授权。该检测是首批获得紧急使用授权的高通量、自动化COVID-19抗体检测之一,它同时还可以帮助筛选用于康复患者血浆疗法的血浆捐赠。FDA今天同时授予Chembio Diagnostics公司开发的DPP COVID-19检测系统紧急使用授权。DPP COVID-19系统是一种血清学床旁检测(point-of-care),可在15分钟内,通过检验手指针刺血滴样本,获得针对新冠病毒的IgM和IgG水平的数值读数。据悉,这些检测均需要在各自特定的生化免疫分析仪上进行。
3.Alnylam在研RNAi疗法获FDA快速通道资格。FDA授予Alnylam公司在研RNAi疗法vutrisiran快速通道资格,用于治疗成人遗传性转甲状腺素蛋白(hATTR)淀粉样变性引起的多发性神经病。目前,Alnylam正在开展两项III期临床(HELIOS-A,HELIOS-B),HELIOS-A研究旨在证明vutrisiran在治疗神经损伤方面是否优于Onpattro。HELIOS-B研究评估vutrisiran对与心血管疾病相关的全因死亡率和住院率的影响。这两项研究数据预计在2021年初获得。此外,vutrisiran在美国和欧盟还被授予治疗ATTR淀粉样变性的孤儿药资格。
4.雅培大规模推出血清学检测试剂盒。雅培宣布推出一款基于实验室的血清学血液测试,用于检测针对新冠病毒的IgG抗体。除了发现曾被新冠病毒感染的人群以外,这一测试将提供对新冠病毒更多的了解,包括抗体在体内停留多长时间以及是否提供免疫力。目前,雅培正在大幅扩大抗体检测的生产规模,预计本周将可发送近100万份检测试剂盒,4月份将总计发货400万份。雅培计划向FDA提交紧急使用授权申请,以及在欧盟提交CE认证申请。
5.诺华与TScan公司合作开发创新T细胞疗法。致力于开发T细胞疗法的TScan Therapeutics公司与诺华达成合作协议,以发现并开发新型的T细胞受体(TCR)细胞疗法。根据协议,双方将利用TScan的专有平台来开发新型TCR细胞疗法,诺华将有权获得多达靶向三个新靶点的TCR细胞疗法的研发权益。此外,诺华还将对就合作产生的额外靶点和TCRs保留选择权。TScan将获总额为3000万美元的前期付款和研究资金,以及根据临床、监管和销售额而定的潜在里程碑付款,其总额可能达到数亿美元。
6.Insilico与勃林格殷格翰达成研发合作。Insilico Medicine公司与勃林格殷格翰达成一项研究合作,双方将利用Insilico 在人工智能方面的专业技术和专有的Pandomics发现平台开发多种疾病的潜在治疗靶点。Insilico公司致力于从三个方面推动药物发现和开发:靶标识别、合成新分子(合成化学)和合成生物学数据(合成生物学),以及预测临床试验结果。据悉该公司使用其人工智能系统“GENTRL”设计DDR1抑制剂,从靶点选择到活性分子筛选和初步验证,总时长仅花费46天。
1.近两成无症状感染者最终转归为确诊病例。4月15日,国家卫健委在国务院联防联控机制新闻发布会上通报,截至4月14日,全国累计报告无症状感染者6764例,其中境外输入588例;近两成转归为确诊病例,累计转归为确诊病例1297例。国家卫健委表示,早期在大量流行病学调查过程中发现了无症状感染者存在潜在的传播风险,此后国家积极采取一系列措施对无症状感染者进行管控,实践证明这些措施是有效的。
2.国家发改委发文 探索互联网医疗医保首诊制。国家发改委、中央网信办发布《关于推进“上云用数赋智”行动 培育新经济发展实施方案》的通知。文中重点提到“以国家数字经济创新发展试验区为载体,在卫生健康领域探索推进互联网医疗医保首诊制和预约分诊制,开展互联网医疗的医保结算、支付标准、药品网售、分级诊疗、远程会诊、多点执业、家庭医生、线上生态圈接诊等改革试点、实践探索和应用推广。”
3.安徽对7名抗疫医务人员直接认定高一级职称。安徽省对在疫情防控工作中作出突出贡献并获得国家表彰的7名医务工作者直接认定高一级职称。7名医务工作者分别为:安徽医科大学第一附属医院主任护师陈红、肥东县人民医院呼吸内科主任医师张成元、蚌埠市第一人民医院呼吸内科主任医师王长海、合肥京东方医院神经内科主任医师王建明、安徽中医药大学第一附属医院主任护师赵红、淮南市第一人民医院副主任护师夏晓丹、安徽省立医院副主任护师朱守俊。
【迈克生物】公司的新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)于美国时间2020年4月15日获得美国食品药品监督管理局(FDA)签发的紧急使用授权。
【同和药业】2020 Q1归属于上市公司股东的净利润为1,579.08万元,比上年同期增长253.22%。归属于上市公司股东的扣除非经常性损益的净利润为1,521.44万元,比上年同期增长308.19%。
【博晖创新】公司拟向珠海奥森发行股份购买其设立的境内SPV 100%股权,并通过该境内SPV最终持有Adchim SAS 100%的股权,同时公司拟向珠海奥森非公开发行股份募集配套资金。
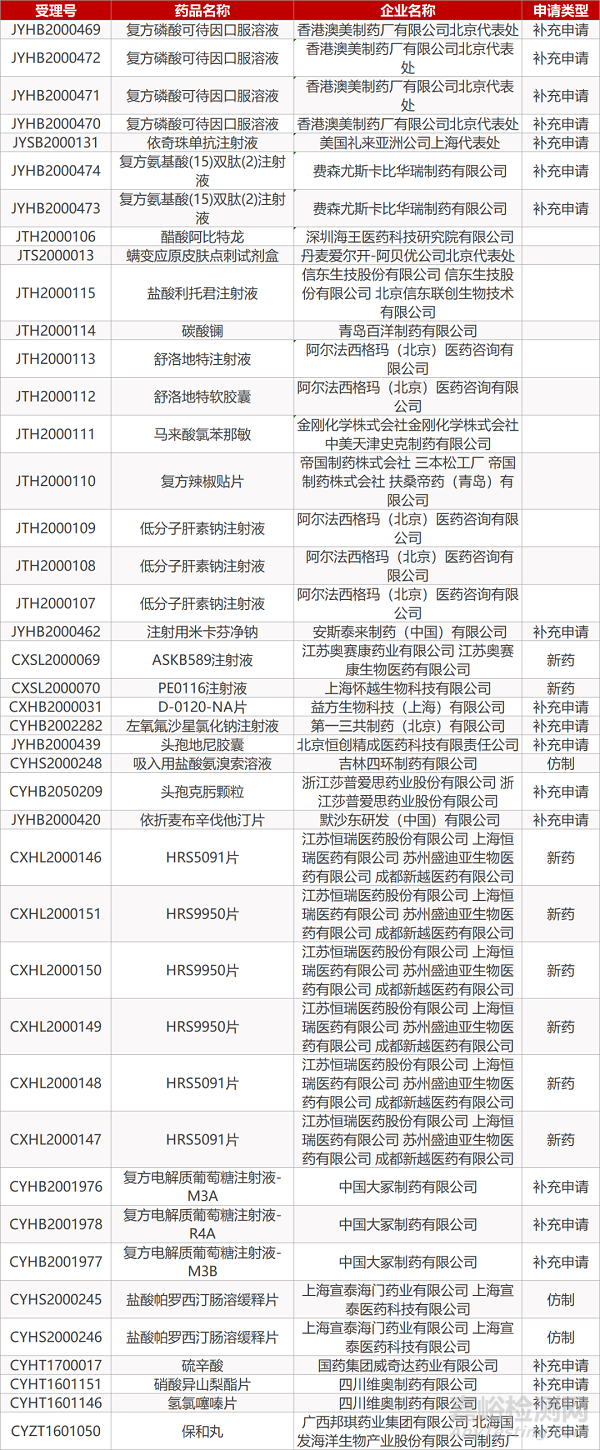
1. CDE最新受理情况(4月16日)
- The End -

来源:药研发


