1、 为什么要重视质量标准
IND申请是创新药研发的重要时间节点之一,是所研发新药第一次接受专业审评,决定其是否能如期开展临床试验的关键。
IND申请阶段重点关注新药的安全性,安全性是建立在质量可控基础之上的,质量标准是确保产品质量可控性的重要的技术标准。
2、 IND阶段质量标准特点
新药研发具有明显的阶段性和渐进性,相应的质量标准的要求也具有明显的阶段性和渐进性。因此,IND阶段质量标准要求与后期临床研究阶段及商业化生产阶段并不完全相同。IND阶段由于工艺还未完全确定,且对药物的认识及可供研究数据有限,质量标准的设置通常会相对宽松一些,随着研究深入,无论是进一步增加质量控制项目,还是收紧控制限度都相对方便,反之则容易造成质量标准的重大变更,因此,在确保安全性的前提下,在IND阶段尽量不要把控制限度定的过紧。
3、 IND阶段质量标准建立一般流程
在IND申请阶段,质量标准设立流程如下:
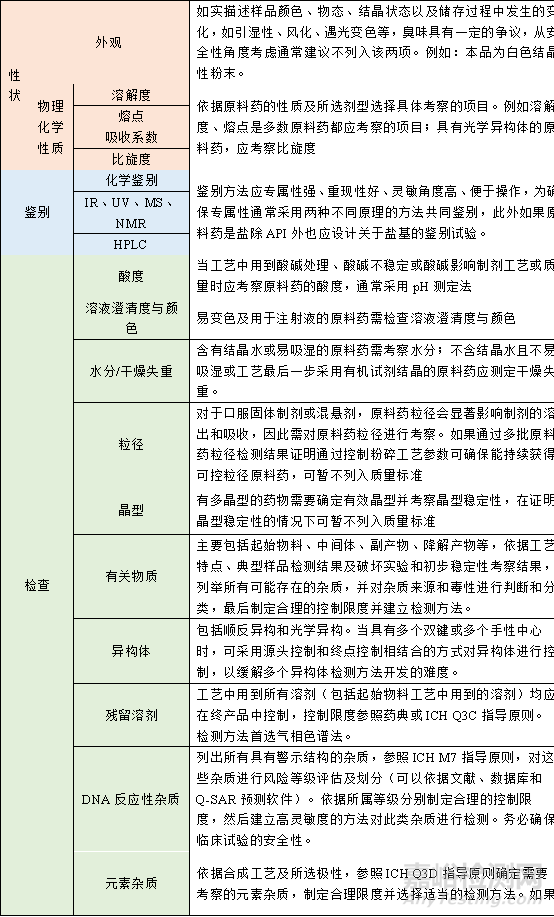
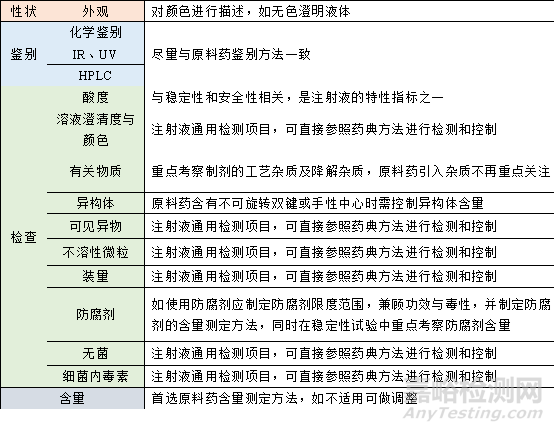
1)依据原料药的特性及设定的剂型,全面分析与安全性、有效性相关的项目。
2)建立可靠的分析方法。
3)根据早期工艺特点、典型批次数据(包括申报批次、临床批次和毒理批样品)及初期稳定性研究结果确定合理的限度。
4)经过充分考察和数据积累,确定哪些项目列入质量标准哪些项目可以暂不列入质量标准。
5)随研发的进程推进、分析技术发展、生产工艺的放大和成熟以及产品质量数据积累,对质量标准进行修订。
4、 IND阶段质量标准一般通用格式
下表分别列举了原料药和片剂、溶液注射液的质量标准控制项目的考虑和设置。
表1 IND阶段原料药质量标准关注项目
表2 IND阶段片剂质量标准关注项目
表3 IND阶段注射液质量标准关注项目
5 结论
在IND阶段,尤其是研究早期,由于工艺还未完全确定,产品质量存在较大变数,质量标准一味追求严格可能会面临后期的重大变更,太过松懈又无法确保安全性,因此在这一阶段质量控制既要符合阶段性研究特点,重点关注安全性,同时也要注意与后期质量控制的衔接,尽量寻找两者的平衡点。
参考文献:
[1]ICH Q系列及M系列指导原则
[2]中国药典2020年版四部通则
[3]化学药物质量标准建立的规范化过程技术指导原则