您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-12-05 21:54
新闻汇总
欧洲
欧盟消费者安全科学委员会发布关于纳米胶体银的安全评估意见(2010.11)
欧盟委员会消费者安全科学委员会(SCCS)发表了关于胶体银(纳米)的意见。
SCCS被要求确定该物质在化妆品中使用时的安全性 - 包括牙膏和皮肤护理产品 - 最大浓度限值为1%,同时考虑到合理可预见的暴露条件。但申请人只提供了少量符合SCCS化妆品中纳米材料安全评估指南(SCCS 1484/12)的数据。 提供的数据不符合SCCS关于纳米材料安全档案中的相关性、充分性和数据质量(SCCS / 1524/13)。 尽管有关纳米银毒性的公开文献中提供了其他信息,但申请人尚未考虑它们与本申请材料的相关性。 由于存在许多主要数据缺口,SCCS无法评估纳米形式的胶体银在口腔和皮肤护理化妆品中使用的安全性。
欧盟消费者安全科学委员会SCCS修订化妆品及其成分评估指南(2018.11.08)
欧盟委员会消费者安全科学委员会(SCCS)已发布欧盟化妆品及其成分安全性评估指南第10版。
SCCS于10月24日至25日举行的全体会议之后通过的第十版说明包括:
毒理学关注阈值(TTC)没有改变。
SCCS认为,该指南不应被视为一种规定程序,而是概述了一种可能需要根据具体情况进行调整的方法。但是,如果与安全评估要求和程序有重大偏差,申请人必须提供科学依据。
欧盟委员会更新欧盟化妆品法规附录V (2018.11.26)
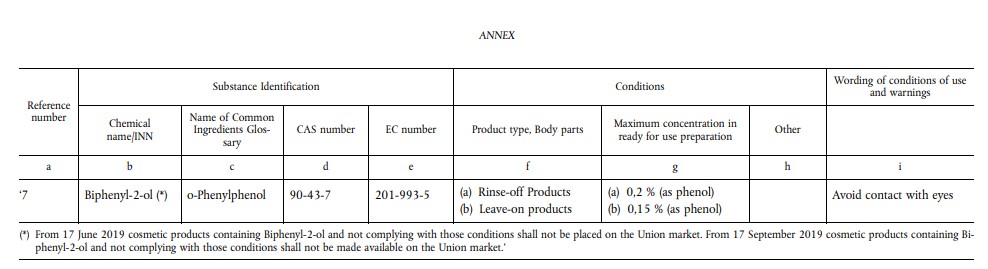
2018年11月26日,欧盟公布了欧盟化妆品法规1223/2009修订案2018/1847号,修订了附录V中关于邻苯基苯酚规定的相关条款。修订后的规定:苯基苯酚及其盐类在化妆品中用作防腐剂,但最大浓度在停留类和冲洗类化妆品中分别为0.15%(以苯酚计)和0.2%(以苯酚计)。 此外,应在标签上标示警示语“避免与眼睛接触”。不允许使用邻苯基苯酚钠,邻苯基苯酚钾和邻苯基苯酚MEA作为防腐剂。
对于不符合新规的含邻苯基苯酚化妆品,自2019年6月17日起将禁止在欧盟市场上市,自2019年9月17日起将禁止在欧盟市场销售。对于含有防腐剂邻苯基苯酚钠、邻苯基苯酚钾或邻苯基苯酚MEA盐的化妆品,自2019年6月17日起将禁止在欧盟市场上市,自2019年9月17日起将禁止在欧盟市场销售。
美洲
美国食品药品管理局建议开展消费者化妆品过敏原调查(2018.11.08)
美国食品和药物管理局(FDA)正在就一项关于化妆品过敏原的消费者调查提出公众意见。这是自1975年以来FDA首次关于消费者对化妆品的看法进行的调查。
根据联邦公报的通知,调查的目的是收集信息,以改善FDA对化妆品中过敏原引起的不良事件的理解。
该机构还希望更好地掌握“消费者对化妆品过敏原的看法和认知以及消费者行为”。这包括购买特定产品或避免某些成分的决定,何时联系医疗保健提供者,以及何时报告不良事件。
为了推进调查,FDA必须得到白宫管理预算办公室(OMB)的批准。该过程的第一步是进行公众咨询。
如果FDA获得OMB的许可,该调查计划将于2019年开始进行。
加拿大政府发现某化妆品色素具有致癌风险 (2018.11.08)
根据加拿大政府的一份结论草案,溶剂紫13是一种在各种消费品(包括化妆品和玩具)中发现的着色剂,在目前的暴露水平下对人体健康有害。如果得到确认,结论很可能会引发针对该物质的风险管理措施。然而,业界表示,评估未考虑溶剂紫13 REACH注册档案中可获得的最新毒性数据。
政府于11月3日公布了7种蒽醌类物质的筛选评估草案。这些物质在化妆品、食品包装材料、儿童工艺品、玩具、自助产品和纺织品中用作着色剂。分别为溶剂紫13、颜料蓝60、溶剂紫59、溶剂蓝36、分散红60酸性蓝239和“9,10-蒽二酮,1,4-二氨基 - ,N,N'-混合的2-乙基己基”,包括甲基 - 和戊基 - 衍生物。
由于缺乏健康影响数据,这些物质的筛选评估草案用于人类健康危害。评估草案发现除了颜料蓝60之外,所有这些都可能导致致癌性,并且可能对溶剂紫13和溶剂蓝36产生不利的发展影响。
评估得出结论,颜料蓝60,因其使用具有致癌性作为关键效应,符合加拿大环境保护法(Cepa)第64节中的标准之一。
该评估使用了“有机物质的生态风险分类”方法来预测环境风险,该方法于2016年由加拿大环境与气候变化局公布。由此得出的结论是,所有七种物质都对环境造成了较低的危害。
南方共同市场公布化妆品生产和分销决议 (2018.11.19)
南美洲贸易区块南方共同市场公布了第44/18号决议,其中列出了个人护理产品、化妆品和香水在投放市场之前的制造和分销要求。要求包括向卫生当局报告:
11月8日的南方共同市场决议将于2019年5月纳入阿根廷,巴西,乌拉圭和巴拉圭的法律体系,并撤销南方共同市场第26/04号决议。
亚洲
帕劳拟将自2020年起禁止10种防晒物质 (2018.11.01)
2018年10月25日,帕劳共和国发布禁令,将禁止企业制造或进口含有十种有害防晒霜成分的产品。十种防晒剂分别为:二苯甲酮-3;甲氧基肉桂酸辛酯; 奥克立林; 4-甲基亚苄基樟脑; 三氯生; 对羟基苯甲酸甲酯;对羟基苯甲酸乙酯;对羟基苯甲酸丁酯;对羟基苯甲酸苄酯;和苯氧乙醇。
从2020年1月1日开始,任何人都不得携带、购买、出售、进口或制造含有这些成分的产品进入帕劳共和国。任何进入帕劳的违禁物品都将被没收。违反法律的零售商每次违规将被处以最高1000美元的罚款。
帕劳的防晒霜禁令遵循夏威夷的脚步,夏威夷于7月成为美国第一个禁止销售或分销含有羟苯甲酮和辛酸酯的防晒剂的州。夏威夷的禁令于2021年生效。
关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告(2018年第88号)(2018.11.09)
为贯彻落实《国务院关于在全国推开“证照分离”改革的通知》(国发〔2018〕35号)要求,现就在全国范围实施进口非特殊用途化妆品备案管理工作有关事宜公告如下:
一、自2018年11月10日起,首次进口非特殊用途化妆品由现行审批管理和自贸试验区试点实施备案管理,调整为全国统一备案管理,国家药品监督管理部门不再受理进口非特殊用途化妆品行政许可申请。
二、进口化妆品生产企业应当在产品进口前,委托境内责任人登录国家药品监管局政务网站(www.nmpa.gov.cn)“网上办事”栏目,通过“进口非特殊用途化妆品备案管理系统”网络平台,办理备案手续,取得电子版备案凭证后方可进口。备案产品按照“国妆网备进字(境内责任人所在省份简称)+四位年份数字+六位顺序编号”的规则进行编号。
三、境内责任人注册地在天津、辽宁、上海、浙江、福建、河南、湖北、广东、重庆、四川、陕西等前期已经开展自贸试验区试点实施进口非特殊用途化妆品备案管理的省(市)行政区域范围内的,在备案系统填报上传完成电子版资料后,向所在地省级食品药品监督管理部门办理备案。有关省级食品药品监管部门应当及时制定本行政区域内备案管理相关办事指南,并向社会公开。境内责任人注册地在其他省(区、市)行政区域范围内的,在网上备案系统填报上传完成电子版资料后,向国家药品监督管理部门办理备案。
四、已经备案产品拟在境内责任人所在地省(区、市)行政区域以外的口岸进口的,应当通过备案系统补充填报进口口岸和收货人等相关信息后方可进口。
五、申请进口非特殊用途化妆品备案的进口化妆品生产企业,应当参照原食品药品监管总局发布的《关于发布上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)的公告》(2017年 第10号)相关要求,进行境内责任人授权、备案系统用户名称注册、产品备案信息报送、备案信息凭证打印等相关工作。
关于进口非特殊用途化妆品检验报告、境内化妆品企业委托境外企业生产等有关事宜,参照原食品药品监管总局办公厅《关于明确浦东新区试点实施进口非特殊用途化妆品备案检验报告要求等有关事宜的通知》(食药监办药化管〔2017〕72号)执行。
六、2018年11月10日前申报行政许可且已被国家药品监督管理部门受理的进口非特殊用途化妆品,申报单位可在2018年11月20日前向国家药品监督管理部门撤回原行政许可申请,后续由境内责任人按照本公告相关要求备案进口。逾期未撤回的,国家药品监督管理部门将按照原程序继续开展技术审核, 符合要求的核发纸质版进口非特殊用途化妆品备案凭证。
2018年11月10日前申请进口非特殊用途化妆品行政许可尚未取得批件的产品,后续可按照本公告相关要求办理备案,涉及产品安全性原因未获批准的除外。
七、按照原审批管理相关法规要求,已获进口非特殊用途化妆品行政许可,在许可有效期内可继续持国家药品监督管理部门核发的纸质版凭证办理进口,期间需要补发或纠错凭证的,按原有规定办理。
在许可有效期结束后仍需继续进口,或者有效期结束前原行政许可事项发生变更的,应当按照本公告要求重新办理备案手续后方可进口。
八、各级药品监管部门应当加大备案进口产品的事中、事后监管力度,加强与海关等有关部门的协调配合,及时通报产品质量安全信息,会同有关部门依法查处相关违法违规行为。
关于29批次化妆品不合格的通告(2018年第113号)(2018.11.08)
经甘肃省药品检验研究院等检验, 15家企业生产的29批次化妆品不合格(不合格清单详见链接)。
上述不合格产品及相关企业违反了《化妆品卫生监督条例》《化妆品标识管理规定》等相关法规的规定。国家药品监督管理局要求广东、江苏、山东、浙江省食品药品监督管理局核实后依法督促相关生产企业对已上市销售相关产品及时采取召回等措施,立案调查,依法严肃处理;要求甘肃、贵州、江西、辽宁、宁夏、上海、陕西、广西等省(区、市)食品药品监督管理局责令相关经营单位立即采取下架等措施控制风险,对涉嫌假冒的产品,要深查深究其进货渠道,对违法违规行为,依法予以查处,涉嫌犯罪的依法移交公安机关。上述省级食品药品监督管理局自通告发布之日起3个月内公开对相关企业或单位的处理结果,相关情况及时在国家化妆品抽检信息系统中填报并报告国家药品监督管理局。
关于30批次化妆品不合格及3批次化妆品复检合格的通告(2018年第118号)(2018.11.26)
经天津市药品检验研究院等检验,标示为大连河原日用化学品有限公司(委托单位:北京顺捷彩悦化妆品有限公司)等15家企业生产的30批次化妆品不合格(见附件1)。
上述不合格产品及相关企业违反了《化妆品卫生监督条例》《化妆品标识管理规定》等相关法规的规定。国家药品监督管理局要求广东、北京、辽宁省(市)药品监督管理部门核实后依法督促相关生产企业对已上市销售相关产品及时采取召回等措施,立案调查,依法严肃处理;要求广东、河北、河南、湖北、江苏、内蒙古、山西、陕西、天津、云南省(区、市)药品监督管理部门责令相关经营单位立即采取下架等措施控制风险,对涉嫌假冒的产品,要深查深究其进货渠道,对违法违规行为,依法予以查处,涉嫌犯罪的依法移交公安机关。上述省级药品监督管理部门自通告发布之日起3个月内公开对相关企业或单位的处理结果,相关情况及时在国家化妆品抽检信息系统中填报并报告国家药品监督管理局。
关于公开征求调整特殊用途化妆品行政许可延续程序有关事宜意见的函(2018.11.30)
进一步规范化妆品注册管理工作,提升化妆品审评审批效率,落实企业主体责任,我司组织起草了关于调整特殊用途化妆品行政许可延续程序有关事宜的规定(征求意见稿)。现向社会公开征求意见,请于2018年12月21日前,将修改意见以电子邮件形式(反馈意见表见附件2)反馈我司。
关于表扬参与查处“4·04”生产销售假冒化妆品案有关单位和人员的通报 (2018.11.08)
“4·04”生产销售假冒化妆品案是一起典型的黑窝点生产销售假冒化妆品案件,是由一个小线索通过不断追根溯源查出的一起大案件。该案的成功查处,有力打击了不法分子利用互联网生产销售违法化妆品的嚣张气焰,体现了药品监管部门在新一轮机构改革期间积极作为、严查大案、坚决维护公众健康安全的决心和意志。
近期,湖南省药品监管部门会同公安机关依法查处了“4·04”生产销售假冒化妆品案,捣毁生产销售窝点15个,查获大量违法化妆品,抓获犯罪嫌疑人19人,涉案金额达1.3亿元。
希望各级药品监管部门深入贯彻落实习近平总书记关于药品安全系列重要指示精神,进一步增强责任感和使命感,继续加大案件查处力度,特别是在机构改革期间,始终保持对药品、医疗器械、化妆品违法行为的高压态势,为保障人民群众的健康安全作出新的更大的贡献。
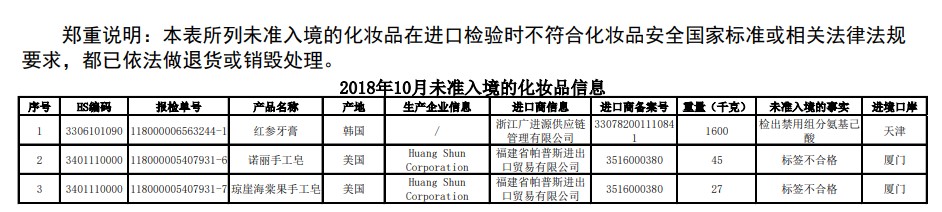
2018年10月未准入境的食品化妆品信息 (2018.11.21)
2018年10月,全国海关在入境货物到达口岸接受监管环节,检出安全项目不合格并未准入境的化妆品3批。未准入境的化妆品来自2个国家或地区,均分别为化妆品原料和发用化妆品检出标签不合格和禁限用物质。对以上未准入境的食品化妆品均已在口岸退运或销毁。
上海食品药品监督管理局发布进口非特殊用途化妆品备案管理工作指引(2018.11.16)
根据《国务院关于在全国推开“证照分离”改革的通知》(国发〔2018〕35号)和 《国家药品监督管理局关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告》(2018年第88号),上海市浦东新区进口非特殊用途化妆品备案试点已向全国推开,我局对原《进口非特殊用途化妆品备案办事指南》有关内容进行了相应调整,更新的办事指南见附件。
海关总署第243号令(关于公布《海关总署关于修改部分规章的决定》的令)(2018.11.23)
其中,对《进出口化妆品检验检疫监督管理办法》(国家质量监督检验检疫总局令第143号公布,根据海关总署令第238号、第240号修改)作如下修改:
一、将第八条第二款修改为:
“其中首次进口化妆品的,应当符合下列要求:
“(一)国家实施卫生许可的化妆品,应当取得国家相关主管部门批准的进口化妆品卫生许可批件,海关对进口化妆品卫生许可批件电子数据进行系统自动比对验核;
“(二)国家实施备案的化妆品,应当凭备案凭证办理报检手续;
“(三)国家没有实施卫生许可或者备案的化妆品,应当提供下列材料:
1.具有相关资质的机构出具的可能存在安全性风险物质的有关安全性评估资料;
2.在生产国家(地区)允许生产、销售的证明文件或者原产地证明;
“(四)销售包装化妆品成品除前三项外,还应当提交中文标签样张和外文标签及翻译件;
“(五)非销售包装的化妆品成品还应当提供包括产品的名称、数/重量、规格、产地、生产批号和限期使用日期(生产日期和保质期)、加施包装的目的地名称、加施包装的工厂名称、地址、联系方式。”
本条款修改前内容如下:

中华人民共和国政府和加拿大政府关于应对海洋垃圾和塑料的联合声明(2018.11.14)
2018年11月14日,中华人民共和国国务院总理李克强与加拿大总理贾斯廷·特鲁多于新加坡举行第三次中加总理年度对话。双方认为,采取可持续的全生命周期法管理塑料,对减轻塑料对环境的威胁,尤其是对减少海洋垃圾具有重要意义。并指出减少化妆品和个人护理消费品中塑料微珠的使用,并处理其他来源的微塑料。更多详情,请见下方链接:
广东省FDA对5家化妆品厂开展飞行检查(88期-92期)(2018.11.19)
检查发现缺陷和问题:
一、机构与人员存在问题
企业质量负责人不在岗,未能有效履行质量管理责任;部分直接接触产品的生产人员未按要求每年接受健康检查,不能提供有效的健康证明。
二、质量管理存在问题
现场包装线部分产品无批生产记录,灌装前半成品无检验记录;成品仓存放已退货的部分产品无不合格处理记录;半成品和成品的检验记录信息不全;抽查了部分产品,原料和产品的放行未经质量管理部门批准;成品散存于包材仓,未进行专区存放,无是否合格标识。
三、厂房及设施存在问题
一楼进入准清洁区未设置洗手、消毒设施;擅自改变已许可车间功能布局,在二楼标示为脱包间的区域进行粉类产品制作,在蜡基静置间进行蜡基灌装,在缓冲走廊存放大量产品包材;未制定环境监测计划,未对清洁区和准清洁区进行有效监控。
四、设备存在问题
一楼车间乳化设备压力表,检验室称量天平、电热恒温干燥箱等仪表设备未定期校验;未提供水处理生产记录和水处理系统运行记录。
五、物料与产品存在问题
原料仓中部分原料未设置标示卡,未清晰标示原料检验状态;原料仓所有的原料没有检验记录;原料未按待检、合格、不合格状态区分;抽查透明质酸钠原料,未按原料储存条件存放。物料发放没有生产指令和相应记录;退仓物料无明确标识;
处理措施:
部分企业违反了《化妆品生产许可检查要点》的相关要求,已由广州市白云区食品药品监督管理局责令和监督企业限期整改。部分企业已停产整改,企业完成整改并经广州市食品药品监督管理局验收确认前不得恢复生产。
广东省药品监督管理局关于不合格化妆品的通告(2018年第1期)(2018.11.28)
广东省药品监督管理局组织开展了化妆品安全专项整治行动,经监督抽检发现标示为“素莲丝 净化祛痘乳”等9批次产品存在非法添加禁用物质问题(详见附件),产品不合格。广东省药品监督管理局已要求相关地市食品药品监管部门依法对相关生产经营企业立案调查,立即责令企业召回不合格产品,彻底查清不合格产品的批次、数量和流向,并将相关信息通报产品流向地的食品药品监管部门;对涉嫌假冒的产品,要深查深究相关经营企业的进货渠道,严厉打击制假售假化妆品行为;在查清事实的基础上,对企业违法违规问题依法查处,并向社会公开。对标示为非我省企业生产的不合格产品,已将相关信息通知产品标示生产企业所在地监管部门依法调查处理。
各地化妆品经营者应立即停止销售、就地下架封存上述不合格产品,并将有关情况报告当地县(区)食品药品监管部门。
广东省药品监督管理局提醒广大消费者,应关注监管部门发布的不合格化妆品信息,通过正规渠道购买化妆品。如发现被通报的不合格产品仍在销售的,请及时进行投诉举报。举报电话:12331。
广东省药品监督管理局开展进口非特殊用途化妆品备案管理工作政策解读 (2018.11.30)
根据国务院“证照分离”改革的决策部署及国家药品监督管理局在全国范围实施进口非特殊用途化妆品备案管理的工作要求,现就我省开展进口非特殊用途化妆品备案管理工作政策解读如下:
一、政策背景
为贯彻落实国务院“证照分离”改革的决策部署,加快政府职能转变,充分激发市场主体活力,根据《国务院关于在全国推开“证照分离”改革的通知》(国发〔2018〕35号)及《关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告》(国家药品监督管理局公告2018年第88号)(以下简称《公告》)的要求,广东省药品监督管理局发布了《广东省药品监督管理局关于开展进口非特殊用途化妆品备案管理工作的通告》(以下简称《通告》),制定了《进口非特殊用途化妆品备案办事指南》,进一步明确广东省开展进口非特殊用途化妆品备案管理工作具体要求。
二、实施日期及备案范围
自《公告》发布之日起,境内责任人注册地在广东省行政区域范围内的,首次进口非特殊用途化妆品由国家药品监督管理局现行审批管理和自贸试验区试点实施备案管理统一调整为省药品监督管理局备案管理。
三、办理方式
申请首次进口非特殊用途化妆品的进口化妆品生产企业应当在产品进口前,委托境内责任人登录国家药品监管局政务网站(www.nmpa.gov.cn)“网上办事”栏目,通过“进口非特殊用途化妆品备案管理系统”(以下简称“备案系统”)办理账号注册、产品备案信息报送等工作。网上备案平台上传完成电子版备案资料后,向负责备案管理的相关部门办理备案。
……
六、境内责任人和在华申报责任单位的区别
《化妆品行政许可申报受理规定》(国食药监许〔2009〕856号)中规定的在华申报责任单位是指由境外化妆品生产企业授权委托,负责产品代理申报有关事宜,对申报资料负责并承担相应的法律责任的中国境内独立法人。同一境外化妆品生产企业只能授权一家在华责任申报单位。
境内责任人是指根据境外化妆品生产企业授权,负责产品的进口和经营,并依法承担相应的产品质量安全责任的注册地在广东省的企业法人。境外化妆品生产企业可以根据经营活动的需要,授权多个境内责任人。但授权范围不得重复,同一产品不得授权多个境内责任人。
七、境内责任人vs 收货人的区别
境内责任人受进口企业授权委托,负责产品的进口和经营,并依法承担相应的产品质量安全责任;收货人受境内责任人委托,办理境内责任人所在省份之外的口岸进口事宜,按照委托协议承担连带责任。境内责任人办理备案手续,填报收货人相关信息;收货人不需填报信息,配合所在地监管部门的监督检查。
八、备案管理与许可管理的区别
实施备案管理是在不降低产品安全监管要求的前提下,仅对产品监督管理的方式进行调整。备案管理在资料要求、检验检测、安全性风险评估等保障产品质量安全的主体责任要求方面,与行政许可管理要求一致。境内责任人按照工作程序要求提交备案资料完成备案后即可凭电子备案凭证开展相关经营活动,事中事后监管中发现问题的,通过责令改正、暂停进口、下架、召回等手段,依法进行处理。
广东省药品监督管理局关于开展进口非特殊用途化妆品备案管理工作的通告(2018.11.30)
根据《国务院关于在全国推开“证照分离”改革的通知》(国发〔2018〕35号)及《关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告》(国家药品监督管理局公告2018年第88号,以下简称《公告》)的相关要求,现将广东省开展进口非特殊用途化妆品备案管理工作的有关事项通告如下:
一、自《公告》发布之日起,境内责任人注册地在广东省行政区域范围内的,首次进口非特殊用途化妆品由国家药品监督管理局现行行政审批管理和自贸试验区试点实施备案管理统一调整为省药品监督管理局备案管理。
二、广东省制定了《广东省进口非特殊用途化妆品备案办事指南》(附件)。申请首次进口非特殊用途化妆品的进口化妆品生产企业应当在产品进口前,委托境内责任人登录国家药品监管局政务网站(www.nmpa.gov.cn)“网上办事”栏目,通过“进口非特殊用途化妆品备案管理系统”(以下简称“备案系统”)办理账号注册、产品备案信息报送等工作。
三、在备案系统上传电子版资料后,境内责任人注册地在广州市黄埔区、南沙区,珠海市横琴新区、广东自贸试验区深圳前海蛇口片区行政区域范围内的,向其所在辖区内的相关管理部门办理备案;境内责任人注册地在省内其他行政区域范围内的,向省药品监督管理局办理备案。
境内责任人取得电子版备案凭证后方可进口。备案产品按照“国妆网备进字(粤)+四位年份数字+六位顺序编号”的规则进行编号。
四、已经备案产品拟在境内责任人所在地省(区、市)行政区域以外的口岸进口的,应当通过备案系统补充填报进口口岸和收货人等相关信息后方可进口。
五、国家药品监督管理部门已受理或未取得批件的产品,可按照《公告》及本通告的要求办理备案,涉及产品安全性原因未获批准的除外。
已获进口非特殊用途化妆品行政许可,在许可有效期内可继续持国家药品监督管理部门核发的纸质版凭证办理进口。需要办理变更、延续、补发或纠错凭证的,按照《公告》执行。
六、境内责任人应履行承诺,建立进口非特殊用途化妆品质量安全管理制度,加强产品追溯和质量管理,承担产品的质量安全责任,确保化妆品的进口和经营符合法规和标准的要求。发生产品质量安全问题时,应主动向社会公开相关信息并及时召回。
七、各级药品监管部门(市场监管部门)应当加大备案进口产品的事中、事后监管力度,加强与海关等有关部门的协调配合,及时通报产品质量安全信息,会同有关部门依法查处相关违法违规行为。
产品召回
|
欧盟
|
|||
| 通报国家 | 产品 | 原因 | 措施 |
| 英国 |
产品类别:化妆品 产品名称:面膜 产品描述: 塑料罐,内含面膜泥,已在网络平台销售(亚马逊等)。 原产地:美国 |
微生物危害 需氧菌的总数(测量量高达3600 cfu / g)和产品中的霉菌水平太高。 如果产品用于受损皮肤上或与眼睛接触,可能会引起感染或刺激。 该产品不符合欧盟化妆品法规的规定。 |
经济运营商(其他)采取措施: 产品从亚马逊平台下架。 进口商采取措施: 销毁产品 |
| 德国 |
产品类别:化妆品 产品名称:染发剂-2款 产品描述: 内包装为带螺旋盖子的塑料瓶,外包装为折叠纸盒。 原产地:泰国 |
化学危害 1款产品含有过多的p-苯二胺和不充分的偶联剂。 未偶联的p-苯二胺是一种非常有效的皮肤致敏物质,可能引发过敏反应。 另1款含有过多的p-苯二胺和甲苯-2,5-二胺硫酸盐(测量值分别为高达4.9%和4.2%重量)和不充分的偶联剂。 未偶联的p-苯二胺和甲苯-2,5-二胺硫酸盐是非常有效的皮肤致敏物,可能引发过敏反应 该产品不符合欧盟化妆品法规的规定。 |
零售商采取措施: 从市场上撤回相关产品 |
| 拉脱维亚 |
产品类别:化妆品 产品名称:保湿霜/啫哩 产品描述:内包装为30ml的塑料管,外包装为折叠纸盒。 原产地:俄罗斯 |
化学危害 该产品为停留类化妆品,含禁用物质甲基异噻唑啉酮(MI);此类物质是过敏物质,对易过敏人群可引起过敏接触性皮炎。 该产品不符合欧盟化妆品法规的规定。 |
进口商采取措施: 从市场上撤回相关产品 |
| 爱尔兰 |
产品类别:化妆品 产品名称:染发剂 产品描述:包装为蓝色盒子 原产地:法国 |
微生物危害 该产品受到需氧嗜温菌,酵母和霉菌的微生物污染(测量值:需氧嗜温菌为77,000 cfu/g,酵母和霉菌为9,000 cfu/g)。 如果产品用于受损皮肤上或与眼睛接触,可能会引起感染或刺激。 该产品不符合欧盟化妆品法规的规定。 |
零售商采取措施: 从市场上撤回相关产品 |
|
根据欧盟化妆品法规的规定,MI和MCI的混合物禁止用于停留类化妆品中,用于冲洗类化妆品中时的浓度应不超过0.0015%。 p-苯二胺在化妆品法规附录III中有规定,只可作为氧化着色剂用于染发类化妆品中,最大允许使用浓度6%(以游离基计)。 欧盟消费者安全科学委员会SCCS在其第10次修订关于化妆品成分测试和其安全性评估指南 (SCCS guidance for the testing of cosmetic ingredients and their safety evaluation)中指出,3岁以下儿童用、眼部或黏膜部位用化妆品的需氧菌、霉菌和酵母菌总数≤100cfu/g ,其他产品≤1000cfu/g。 |
|||
| 挪威 |
产品类别:化妆品 产品名称:亮肤霜-2款 产品描述: 包装为带橘色盖子的白色瓶子。 原产地:象牙海岸 |
化学风险 润肤露含有氢醌(最多2%)。 氢醌引起皮肤刺激和皮炎。 该产品不符合欧盟化妆品法规的规定。 |
经销商采取措施:禁止产品上市和任何补充措施。 |
| 德国 |
产品类别:化妆品 产品名称:染发剂 产品描述: 外包装为塑料罐(1.米黄色塑料罐200ml;2.黄色塑料罐200ml)。 原产地:印度 |
化学风险 该产品含有过多的p-苯二胺(测量值:7.2%)和不充分的偶联剂。 未偶联的p-苯二胺是一种非常有效的皮肤致敏物质,可能引发过敏反应。 该产品不符合欧盟化妆品法规的规定。 |
零售商采取措施: 从市场上撤回相关产品。 |
| 法国 |
产品类别:化妆品 产品名称:抗菌香皂 产品描述: 外包装为绿色折叠纸盒,内含一个带黑色盖子的白色塑料瓶、一个带白色盖子的绿色塑料管、一把梳子和手套。 原产地:印度尼西亚 |
化学风险 该产品含有过量的三氯卡班用作防腐剂(测量值:1.3%)和4-氯苯胺(测量值:0.2%)。 芳香胺可引起癌症和/或过敏反应。 该产品不符合欧盟化妆品法规的规定。 |
零售商采取措施: 从市场上撤回相关产品。 |
| 美国 | 2018年10月,共有52款化妆品被拒绝入关 | 原因主要是:含不安全色素,标签不合格,宣称涉嫌药品。中国占4款:4款均因含有不安全色素,1款还有标签不合格的问题。 |
强制措施: 拒绝入境 |
| 加拿大 | 2018年11月15日,79款被召回,涉及除臭喷雾、止汗喷雾等,原因:无化妆品法规规定的强制性危险标签。 标签不当可能导致产品误用并导致严重伤害。原产地:欧盟70款,美国9款 | 消费者应立即停止使用相关产品,可到商铺退款。 | |

来源:ITS


