您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-24 09:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
首个防治新冠肺炎的中药获临床批件。3月18日,由第一批国家中医医疗队领队、国家中医药管理局中医药防治新冠肺炎专家组组长黄璐琦院士领衔的医疗科研团队研发的化湿败毒颗粒获得临床试验批件。这是国家药监局批复的首个防治新冠肺炎的中药临床批件。化湿败毒颗粒是我国具有自主知识产权、专门针对新冠开发的新药。在临床救治重症COVID-19患者过程中,它在核酸的转阴和症状的改善方面有显著差异;在小鼠试验中,它能够将小鼠肺部的病毒载量降低30%。
1.中国医药瑞舒伐他汀钙胶囊通过一致性评价。中国医药旗下通用三洋的瑞舒伐他汀钙胶囊(5mg、10mg)获国家药监局批准,成为首家通过瑞舒伐他汀钙胶囊一致性评价的产品。瑞舒伐他汀是一种选择性3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,适用于原发性高胆固醇血症(Ⅱa型,包括杂合子家族性高胆固醇血症)或混合性脂血障碍(Ⅱb型)患者在节食或锻炼疗法不理想时的辅助治疗。2018年国内样本医院瑞舒伐他汀销售总额约为11.8亿元。
2.法匹拉韦治疗COVID-19最新临床数据发布。评估法匹拉韦与阿比朵尔对比治疗成人COVID-19患者的临床研究(ChiCTR2000030254)最新数据公布在预印本平台medRxiv上。结果显示,在FAS队列中,在可评估的普通型COVID-19患者中,阿比朵尔组的7天临床恢复率为55.86%,法匹拉韦组为71.43% (P=0.0199);对于普通型COVID-19患者和合并高血压/糖尿病的COVID-19患者,法匹拉韦组的退烧、止咳时间明显短于阿比朵尔组,但两组患者接受辅助氧疗或无创机械通气的比例无统计学意义的差异;最可能的不良事件包括肝功能试验异常、精神症状反应、消化道反应及血尿酸升高。
3.恒瑞1类新药法米替尼获批临床。3月20日,恒瑞1类新药苹果酸法米替尼胶囊获国家药监局两项临床默示许可,分别为:联合注射用卡瑞利珠单抗治疗晚期实体瘤;与注射用卡瑞利珠单抗联用治疗晚期泌尿系统肿瘤及妇科肿瘤。法米替尼是一种口服多靶点受体酪氨酸激酶抑制剂,目前拟开发的适应症包括结直肠癌、胃肠道间质瘤和神经内分泌肿瘤、特发性纤维化和鼻咽癌。
4.京新药业设立全资子公司。京新药业拟以自有资金出资1.2亿元在山东省潍坊市设立全资子公司“山东京新药业有限公司”,以建立原料药生产基地,提升其在原料药、高级医药中间体的市场竞争力。公告显示,生产范围:化学原料药及其制剂、食品添加剂、饲料添加剂、医药中间体(不含危险化学品);销售范围:医药中间体(不含危险化学品);生物技术的研发;国家允许的货物及技术进出口业务。
5.恒瑞医药2019年财报公布。3月22日,恒瑞医药发布2019年年度报告,公司实现营业收入232.89亿元,比去年同期增长33.70%;归属于母公司所有者的净利润53.28亿元,比去年同期增长31.05%。报告期内,抗肿瘤药品营收105.76亿元,较去年增长43.02%,占总营收比达到45.4%;影像产品营收较去年增长 38.97%;麻醉类产品较去年增长18.35%。研发创新方面,2019年累计研发投入38.96亿元,比上年增长45.90%,研发投入占销售收入的比重达到 16.73%。
1.FDA紧急授权首个COVID-19即时检测产品。FDA针对新冠肺炎(COVID-19)即时医疗诊断的检测产品Xpert®Xpress SARS-CoV-2发布首个紧急使用授权,将COVID-19样本的检测时间缩短到了45分钟。该产品可在CLIA认证的中高复杂性实验室以及一些医疗机构中使用。Xpert®Xpress SARS-CoV-2是一款快速分子诊断测试产品,用于定性检测SARS-CoV-2中的核酸。在感染的急性期,通常在鼻咽拭子样本和/或洗鼻液/吸出液样本中可检测到SARS-CoV-2 RNA。
2.杨森递交多发性硬化症新药ponesimod上市申请。强生旗下杨森向FDA递交了特异性S1P1调节剂ponesimod的新药申请,治疗复发多发性硬化症(MS)成人患者。在一项Ⅲ期临床OPTIMUM试验中,与teriflunomide(活性对照组)组相比,ponesimod使MS的年复发率降低了30.5%;其缓解疲劳的关键性次要终点也得以满足,并且与活性对照组相比,治疗组中患者大脑中的合并孤立活动病灶(CUAL)数量减少了56%。
3.诺华RNAi疗法inclisiran三项研究成果正式发表。诺华在研RNAi疗法inclisiran的三项Ⅲ期研究(ORION-9,ORION-10和ORION-11)结果正式发表于《新英格兰医学杂志》上。ORION-9试验针对家族性高胆固醇血症(FH)患者,ORION-10和ORION-11则针对患有动脉粥样硬化性心血管疾病(ASCVD)或具有ASCVD风险的人群。所有试验结果都显示,一年两针,inclisiran可安全有效将患者低密度脂蛋白胆固醇(LDL-C)水平降低约一半。RNA干扰(RNAi)是一种通过双链RNA对基因进行沉默的方法,该机制的发现者也曾在2006年获得诺贝尔生理学或医学奖。
4.Soligenix光敏疗法Ⅲ期临床结果积极。Soligenix公司“first-in-class”光动力疗法SGX301在治疗皮肤T细胞淋巴瘤(CTCL)的Ⅲ期临床中获积极结果。患者接受SGX301或安慰剂的治疗。试验包括3个疗程,每个疗程为8周。试验结果表明,在第一个疗程结束后,SGX301组有16%的患者病变减少至少50%,而对照组这一数值为4%(p=0.04)。在第二个疗程中,所有患者都接受SGX301的治疗。初步结果显示患者缓解率超过35%。第二疗程的结果预计在6月公布。SGX301是一种合成金丝桃素,已获FDA授予的孤儿药资格和快速通道资格。
5.Keytruda+Lenvima组合子宫内膜癌II期研究成果发布。卫材分子靶向疗法Lenvima(乐卫玛,仑伐替尼)联合默沙东抗PD-1疗法Keytruda治疗晚期子宫内膜癌患者的II期临床研究(Study111/KEYNOTE-146,NCT02501096)的阳性结果在线发表于《临床肿瘤学杂志》上。基于该研究数据,2019年9月,FDA加速批准该组合用于治疗既往接受系统治疗后病情进展、不适合根治性手术或放射治疗、不是微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的晚期子宫内膜癌患者;澳大利亚和加拿大的监管部门也已批准这一联合方案用于晚期子宫内膜癌患者。
6.FDA拒绝批准恩格列净治疗1型糖尿病。3月20日,礼来宣布收到FDA的完全回复信。FDA拒绝批准其SGLT2抑制剂恩格列净用于治疗1型糖尿病的补充申请。恩格列净由礼来/勃林格殷格翰共同开发,于2014年8月获得FDA批准治疗2型糖尿病成人患者。2016年12月,FDA又批准了恩格列净降低2型糖尿病患者心血管风险的新适应症。1型糖尿病又称胰岛素依赖型糖尿病,属于慢性自身免疫性疾病,患者需要每天注射胰岛素来维持生存。
1.北京确诊病例亲属密切接触者续发率达17%。3月22日,北京市新冠肺炎疫情防控工作新闻发布会上,北京市疾控中心副主任庞星火介绍,根据北京市确诊病例密切接触者的分析结果显示,亲属密切接触者中续发率达17%,明显高于其他社会关系的密切接触者3%的比例。目前有大量境外来京旅客,一旦发生感染返回家中,将会有较高风险传染。庞星火强调,境外来京人员要积极配合接受集中医学观察。
2.上海将重大突发公卫事件应急响应下调为二级响应。上海市政府新闻办23日发布消息,上海市政府决定自3月24日零时起,将上海市重大突发公共卫生事件应急响应级别由一级响应调整为二级响应。上海市将继续高度重视疫情防控工作,下一步是以严防境外疫情输入为重点,有效做好口岸防控和社区防控,进一步巩固疫情防控成效,统筹推进疫情防控和社会经济发展。
3.湖北开展疫情防控“疾控大培训”。22日,国家卫健委联合湖北开展疫情防控“疾控大培训”。本次培训面向湖北各地疾控中心、医院、乡镇卫生院、社区卫生服务中心等从事公共卫生人员,采取“1+2+3+N”形式进行。具体来说,国家和省级资深专家在湖北开展1次师资培训;对新冠肺炎防控和其他相关疾病预防控制开展2个专题培训;聚焦社区、复工复产复学和特殊重点场所3个当前阶段疫情防控的关键阵地,进行针对性能力实操训练;针对各地区的个性化需求,由对口援鄂防控队支持N个针对性的公共卫生能力建设“定制培训”。
【安科生物】2020年3月21日,全资子公司安科恒益获得有关富马酸丙酚替诺福韦片生产注册申请《受理通知书》
【通化东宝】2020年2月20日,公司累计回购1,610万股,占总股本0.79%,成交最高价为12.90元/股,最低价为12.17元/股,累计支付总金额为2.00亿元。完成本次回购计划。
【天目药业】全资子公司黄山天目及直接和间接持股全资子公司天目薄荷,自2019年1月1日至2019年12 月31日合计收到与收益相关的政府各类补助累计186.99万元(不含公司前期收到并已披露的政府补助)。
1. CDE最新受理情况(3月23日)
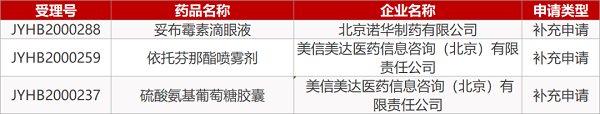
2. FDA最新获批情况(北美3月20日)
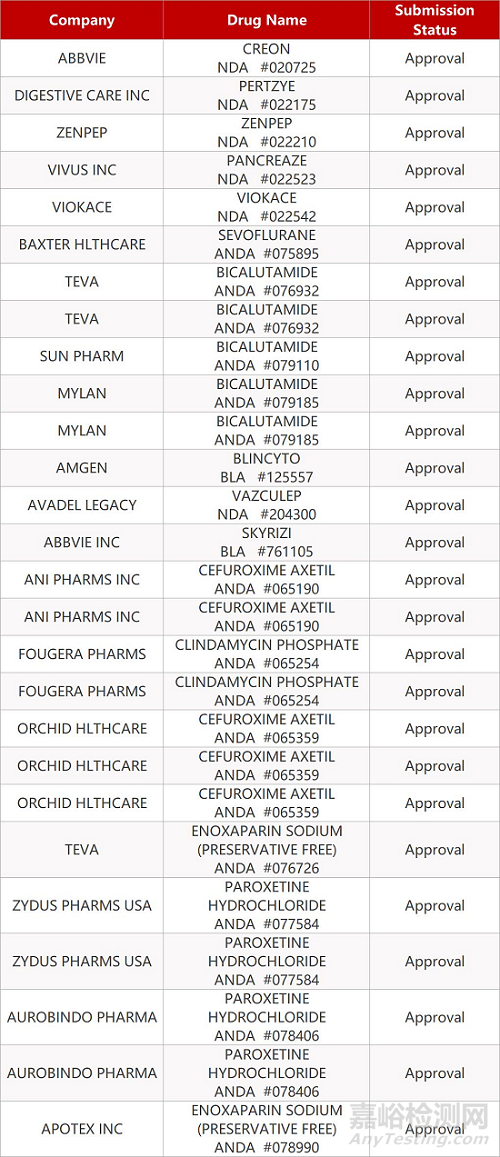
- The End -

来源:药研发


