您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-15 09:52
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.东阳光磷酸依米他韦胶囊进入行政审批阶段。东阳光1类新药「磷酸依米他韦胶囊」上市申请审评状态变更为「在审批」。依米他韦是一种抗丙肝口服直接抗病毒药物(DAA),同时也是东阳光首个报上市的1类新药。在中国大陆地区完成的II期/III期临床试验数据显示,该新药针对基因1型无肝硬化丙肝患者疗效显著,SVR12(12 周持续病毒应答率)达 99.8%,且用药安全性及耐受性良好。
2.依帕伐单抗在中国提交上市申请。由Swedish Orphan Biovitrum AB(下称Sobi公司)、Patheon Italia公司和苏庇医药共同提交的三项依帕伐单抗注射液(emapalumab)的新药上市申请获CDE受理。依帕伐单抗是一款IFNγ靶向单抗,曾获FDA授予的突破性疗法认定、优先审评资格和孤儿药资格。2018年,emapalumab获得FDA批准,用于治疗儿童或成年原发性噬血细胞性淋巴组织细胞增多症患者。emapalumab也是FDA批准的首款针对这类患者的抗体疗法。
3.开拓药业普克鲁胺治疗COVID-19临床结果积极。开拓药业新一代AR拮抗剂普克鲁胺正在巴西进行的治疗COVID-19的临床试验结果积极。该试验(NCT04446429)旨在探索普克鲁胺在人体内延缓新冠病毒感染过程中的作用,主要终点包括30天内因COVID-19住院的受试者百分比和临床症状评估。初步结果显示,普克鲁胺治疗组的住院率为0.8%,使用呼吸机百分比为0%,死亡百分比为0%;对照组住院率为27.0%,使用呼吸机百分比为9%,死亡百分比为2%。该研究最终报告将于2021年1月完成。
4.绿叶制药戈舍瑞林缓释微球临床新进展。绿叶制药自主研发的创新制剂注射用醋酸戈舍瑞林缓释微球(LY01005)在中国完成针对乳腺癌III期临床研究的首例患者入组。戈舍瑞林是一种促性腺激素释放激素激动剂,用于前列腺癌、乳腺癌及子宫内膜异位症等若干病症的治疗。目前该新药正在中美两国进行临床开发,其中针对前列腺癌的中国III期临床正在进行当中。
5.烨辉医药ROCK2抑制剂拟纳入突破性疗法认证。Kadmon/烨辉医药联合开发的口服选择性 ROCK2抑制剂Belumosudil(KD025/BN101)获CDE纳入拟突破性疗法认定公示名单,用于治疗至少经过一线系统治疗的慢性移植物抗宿主病(cGVHD)。此前FDA已受理Belumosudil治疗cGVHD的上市申请并授予其优先审评资格。在一项II期临床ROCKstar(NCT03640481)中,200mg Belumosudil在既往接受过至少二线系统疗法的患者中ORR达到74%。
6.歌礼NASH候选药物ASC42获FDA快速通道资格。歌礼制药旗下甘莱公司宣布,FDA授予其非酒精性脂肪性肝炎(NASH) 候选药物ASC42快速通道资格。ASC42是一种完全自主研发的、“best-in-class”新型高效选择性FXR激动剂,已在两个NASH动物模型中显示出了对肝脏脂肪变性、炎症和纤维化的显著改善。今年10月,ASC42获FDA批准在NASH患者中开展临床试验。目前,美国尚无NASH药物获批上市。
国际药讯
1.Keytruda结直肠癌适应症获欧盟CHMP推荐批准。欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐批准默沙东Keytruda(帕博利珠单抗)的新适应症,用于单药一线治疗微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)结直肠癌成年患者。在一项III期临床KEYNOTE-177(NCT02563002)中,在中位随访32.4个月后的第二次中期分析时,帕博利珠单抗在无进展生存期方面优于化疗(中位数,16.5 vs 8.2个月;风险比,0.60;95%置信区间[CI];P=0.0002)。
2.罗氏发布Tecentriq早期膀胱癌Ⅲ探索性数据。罗氏(Roche)在ESMO IO2020年会上公布其Tecentriq®(atezolizumab)辅助单药治疗肌肉浸润性尿路上皮癌(MIUC)患者(术后)的Ⅲ期临床IMvigor010探索性分析结果。在循环肿瘤DNA(ctDNA)患者中,与临床观察相比,Tecentriq使患者的无病生存期(DFS)有所提高(中位数为5.9个月对比4.4个月,危险比[HR]=0.58;95%CI:0.43-0.79)。中期分析的总生存率(OS)也显示在ctDNA阳性人群中使用Tecentriq治疗更有益,与观察(15.8个月)相比,Tecentriq治疗组的中位OS为25.8个月(HR=0.59;95%CI:0.41-0.86)。
3.赛诺菲/GSK推迟COVID-19疫苗计划。赛诺菲和葛兰素史克(GSK)宣布推迟COVID-19佐剂疫苗的试验计划,以改善该疫苗在老年人群的免疫反应。根据最新的Ⅰ/Ⅱ期研究中期结果,接受该疫苗18至49岁成年人的免疫应答反应与从COVID-19中恢复的患者相当,但老年人群的免疫应答反应则较低。两家公司认为这可能是由于抗原浓度不足引起。该疫苗原计划2020年底启动III期临床,2021上半年提交上市申请。但受此次不利结果影响,该疫苗将在2021年2月启动一项Ⅱb期临床,2021年第二季度启动III期临床。如若顺利,2021年下半年将向监管机构提交上市申请。
4.吉利德囊获一款新型肝炎疗法。吉利德拟收购德国生物技术公司MYR GmbH,并获得其研发的一款“first-in-class”肝炎疗法Hepcludex。Hepcludex(bulevirtide)目前已在欧盟获有条件批准上市,用于治疗慢性丁型肝炎(丁肝)病毒感染。在美国,Hepcludex也已获得FDA授予的孤儿药资格和突破性疗法认定。预计2021年下半年向FDA递交加速获批的上市申请。依照协议,MYR GmbH将获得约11.5亿欧元现金,以及3亿欧元的潜在里程碑付款。
5.Astellas公司与KaliVir公司达成合作协议。生物技术公司KaliVir Immunotherapeutics与Astellas Pharma达成一项开发和商业化溶瘤病毒候选产品VET2-L2的全球授权协议,以及共同开发另一款溶瘤病毒疗法的合作。KaliVir独特的VET平台能开发出可静脉递送的下一代溶瘤病毒免疫疗法,并有效提高其复制、传播能力和调节肿瘤微环境。根据协议,KaliVir将获高达5600万美元的预付款,VET2-L2和第二款产品多达3.07亿美元和2.71亿美元的里程碑付款以及产品的销售版税。
医药热点
1.北京大学成立国家级公卫智库。12月12日,北京大学成立公众健康与重大疫情防控战略研究中心。该中心旨在打造一个多学科相互渗透、相互支撑的跨学科研究平台,大力培养复合型、创新型公共卫生专业人才,并为政府提供公共卫生决策的科技支撑等。该中心设立科学顾问委员会、学术委员会和管理委员会,分别由北京大学校长郝平、中国科学院院士韩启德、中国工程院院士詹启敏担任主任委员。
2.美国:1个人1场会议致全球30万人感染。据美国《科学》杂志10日发表的一项研究,通过追踪病毒的基因指纹,研究人员发现今年2月份在美国波士顿举办的一场会议,目前已经导致全球30万人感染新冠病毒。今年早些时候,研究人员发现两个特殊的病毒基因指纹与这场会议有关。其中一枚基因指纹传播到美国29个州,以及澳大利亚等国家,最终导致全球24.5万人感染新冠病毒,该基因指纹的另一个变种,导致美国至少8.8万人感染。而这枚基因指纹,最早是由一个携带病毒的参会人员带到这场会议上的。
3.2020国家医保目录谈判启动。12月14日,2020年国家医保目录药品谈判正式开始。此次谈判共四天,谈判时间分为上午、中午和晚上三个时间段。一天最多可能要谈80多个品种。今年报价和去年一样,分为两轮,只有报价落在医保局15%的范围内才能继续谈。现场有5个谈判专家,都是来自各省的医保局专家。截止目前,尚未有确切的官方信息统计到底有多少个品种进入医保谈判。
股市资讯
【新产业】公司产品“Ⅰ型单纯疱疹病毒IgG抗体检测试剂盒(化学发光免疫分析法)”获得医疗器械注册证,用于体外定性检测人血清或血浆中Ⅰ型单纯疱疹病毒IgG抗体。
【健友股份】公司产品“盐酸吉西他滨注射液,200mg/5.26mL,1g/26.3mL,2g/52.6mL”获得美国FDA签发的ANDA批准通知,该产品可与卡铂联合治疗卵巢癌;与紫杉醇联合治疗乳腺癌;与顺铂联合治疗非小细胞肺癌;单药治疗胰腺癌。
【海思科】公司创新药“环泊酚注射液” 通过优先审评审批程序获批上市,该产品为GABAA受体激动剂,为麻醉镇静药,用于消化道内镜检查中的镇静。
审评动向
2. FDA最新获批情况(北美12月11日)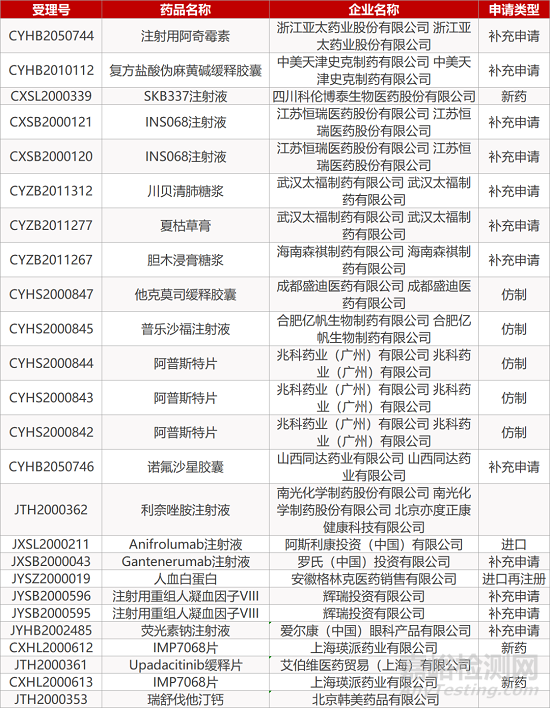
暂无
- The End -

来源:药研发


