您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-21 20:17
目前FDA对采血针的分类是I类,不需510(k)。
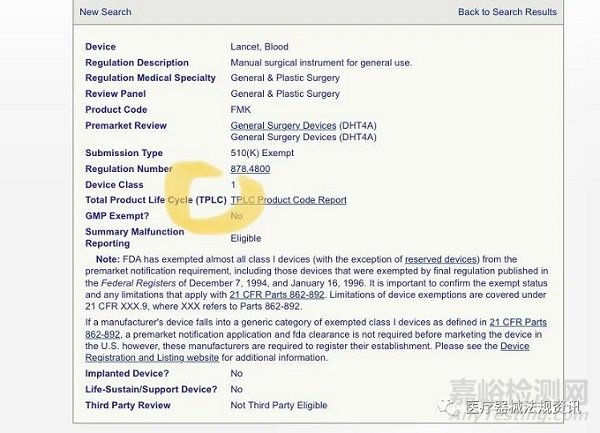
在2021.11.20,FDA发布了最终命令,将采血针的分类由I类调整为II,III类,以确保采血针在家用和医护环境中的安全有效的使用。
重新分类简述如下:
1. 目前以下三类单个患者使用的采血针,由I类重新分类为II类,需要走510(k)上市途径。
• single use only blood lancets with an integral sharps injury prevention feature,
• single use only blood lancets without an integral sharps injury prevention feature, and
• multiple use blood lancets for single patient use only
2. 多个患者使用的采血针,由I类重新分类为III类,需要PMA,或告知完成产品开发协议(PDP)。
重新分类的要求将于2021.11.22开始生效。
过渡期相关规定:
1. 所有多个患者使用的多次使用的采血针的制造商,在2021.11.22之后30个月内需要完成PMA才能上市。
2. 对于单个患者使用的采血针,如果在2021.11.22之前没有在美国销售,则在上市销售之前需要完成510(k)。
3. 对于单个患者使用的采血针,如果在2021.11.22.之前已经在美国销售了,且未做510(k),则需在2023.11.22之前完成510(k)。

来源:医疗器械法规资讯


