您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-24 14:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.石药IgG4抗体关键临床积极。石药集团附属公司津曼特生物开发的新型抗RANKL(IgG4)单抗JMT103,在治疗不可切除或手术困难的骨巨细胞瘤的关键临床(JMT103CN03和JMT103CN03-1)达到预设的终点指标。在JMT103CN03临床中,JMT103的肿瘤反应率达到93.5%;并提高可以手术切除的患者比例。JMT103CN03-1回顾性研究结果显示,JMT103的肿瘤反应率显著优于非地舒单抗组,同时呈现出高于地舒单抗组的趋势。石药计划递交该新药的上市前沟通交流申请。
2.科济CAR-T上实体瘤Ⅱ期临床。科济药业自主研发的CAR-T产品CT041在用于治疗既往接受过至少二线治疗失败的CLDN18.2表达阳性的晚期胃癌/食管胃结合部腺癌的中国Ⅱ期临床首例患者入组。CT041是一款靶向CLDN18.2的自体CAR-T,此前已分别获FDA和EMA授予的孤儿药资格,EMA授予的优先药物(PRIME)资格,以及FDA授予的再生医学先进疗法资格。科济拟开发CT041作为骨干疗法,用于治疗胃癌和胰腺癌。
3.先声PRMT5抑制剂获批临床。先声药业自主研发的1类新药SCR-6920胶囊获国家药监局临床试验默示许可,拟用于治疗晚期实体瘤。SCR-6920是一款口服蛋白精氨酸甲基转移酶5(PRMT5)抑制剂,与甲硫腺苷磷酸化酶(MTAP)构成一对合成致死基因。SCR-6920对PRMT5活性抑制有高度选择性和效力,在体外展现出对多种血液瘤和实体瘤细胞的增殖抑制活性,且单药能显著抑制多个小鼠CDX模型中的肿瘤生长。此外,SCR-6920具有良好的安全性。
4.舶望超4亿融资推进siRNA药物开发。致力于开发新一代siRNA药物的舶望制药完成超4亿元A轮融资,本轮融资由正心谷资本领投,CPE源峰、道远资本、三一创新投资、金沙江联合创投等多家机构共同投资。本轮融资将主要用于推进该公司心血管疾病和罕见病管线的新药临床试验申请(IND),以及推进多个临床前候选药物分子(PCC)的发现。预计到2023年会有多个药物进入临床Ⅰ期研究。
5.创胜联合BMS开展全球临床研究。创胜集团Claudin18.2人源化单抗TST001拟联合百时美施贵宝PD-1欧狄沃®(纳武单抗)在中美两地开展两项I/II期临床,评估联合治疗对于无论既往是否接受过治疗的Claudin18.2表达的不可切除的局部晚期或转移性胃癌及胃食管连接部癌患者的安全性和有效性。创胜集团将作为临床研究的申办方。此前,FDA已授予TST001用于治疗胃癌的孤儿药资格。
6.药明生物2021年业绩报告出炉。3月22日,药明生物公布2021年业绩报告,全年营收102.9亿元,同比增长83.3%;归母净利润为33.89亿元,同比增长100.6%。其中,综合项目由去年同期的334个,增长43.7%至480个;临床前项目由去年同期的169个,增长58.6%至268个;早期临床开发项目由去年同期的135个,增长26.7%至171个( 119个I期及52个II期);III期临床项目由去年同期的28个,增长14.3%至32个。
国际药讯
1.武田肺癌靶向药获英国有条件批准。英国药品和保健品监管局有条件批准武田EGFR-TKI靶向药物Exkivity(mobocertinib),用于单药治疗先前接受过含铂化疗、携带表皮生长因子受体(EGFR)外显子20插入突变(Exon20ins+)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是一种极其罕见的癌症,预后比其他EGFR突变更差。Exkivity也是首个获监管批准专门选择性靶向EGFRex20ins突变的口服疗法。
2.诺华CDK4/6抑制剂乳腺癌成果见刊NEJM。诺华靶向抗癌药CDK4/6抑制剂Kisqali联合来曲唑治疗绝经后、HR+/HER2-转移性乳腺癌的Ⅲ期MONALEESA-2研究成果发表在《新英格兰医学杂志》上。中位随访为80个月时,与来曲唑单药相比,联合治疗使中位总生存期延长一年以上(中位OS:63.9个月vs51.4个月;HR=0.76[95%CI:0.63-0.93];p=0.008)。这是该项试验报道随访时间最长的疗效数据,期间没有出现新的安全性信号。
3.诺华RNA靶向疗法亨廷顿病临床积极。诺华小分子RNA剪接调节剂Branapam(LMI070)治疗早期亨廷顿病(HD)的IIb期试验结果积极。Branaplam给药后,患者的成纤维细胞中亨廷顿mRNA及突变亨廷顿蛋白水平均明显降低。研究人员目前正评估Branaplam能否将患者脑脊液中突变亨廷顿蛋白降低到减缓疾病的水平。Branapam最初旨在增强SMN2基因的剪接以治疗脊髓性肌萎缩症(SMA),在试验失败后,诺华拟开发Branapam用于HD适应症。
4.Affini-T拟加速开发新型TCR疗法。Affini-T Therapeutics公司宣布完成1.75亿美元融资。Affini-T旨在利用合成生物学和基因编辑,针对KRAS基因突变开发新型TCR细胞疗法,以用于难治性实体瘤的根除。Affini-T的细胞疗法设计在CD4阳性和CD8阳性T细胞中不但表达靶向致癌突变靶点的T细胞受体(TCR),而且表达一个CD8共受体。获得的资金将用于推动其药物发现平台的运作,将KRAS靶向TCR项目推进临床。
5.多动症改良型新药临床失败。Vallon公司专有速释(IR)右旋安非他明(右苯丙胺)防滥用配方ADAIR用于鼻吸治疗注意力缺陷多动障碍(ADHD)的关键研究SEAL未达主要终点。与碾碎的鼻内吸入硫酸右苯丙胺对照组相比,ADAIR组患者产生的最大药物好感度评分不具有统计学意义的降低。但在12小时和24小时节点的总体药物喜好方面,ADAIR评分显著低于对照组,达到所有药效学次要终点。DAIR的耐受性普遍良好。
6.武田甲状旁腺激素PAS遭FDA拒绝。武田甲状旁腺激素Natpara的补充申请(PAS)收到FDA的完整回复函。Natpara最早于2015年9月获得FDA批准上市,是首个获批的处方甲状旁腺激素,作为钙和维生素D的辅助药物,用于控制慢性甲状旁腺功能减退症患者的低钙血症。此前,由于Natpara药筒的橡胶隔膜可能会产生橡胶颗粒,武田于2019年9月在美国Ⅰ类召回所有剂量规格的Natpara注射产品。
医药热点
1.国家卫健委调整抗新冠病毒药物适应症。23日,国家卫健委发布关于调整抗新型冠状病毒药物PF-07321332/利托那韦片(Paxlovid)适应症等内容的通知。根据国家药监局批准奈玛特韦片/利托那韦片组合包装时核准的说明书,国家卫健委对《新型冠状病毒肺炎诊疗方案(试行第九版)》抗病毒治疗中“PF-07321332/利托那韦片(Paxlovid)”的药物名称调整为“奈玛特韦片/利托那韦片组合包装”,适应症调整为“发病5天以内的轻型和普通型且伴有进展为重症高风险因素的成人”,不再包括青少年。
2.第三版核酸检测指南出炉。国务院联防联控机制综合组出台《区域新型冠状病毒核酸检测组织实施指南(第三版)》,强调在科学研判疫情形势基础上,精准划定检测范围,将第二版《指南》中的“全员”修改为“区域”,区域大小由疫情防控需要决定,指导各地对划定的区域完成核酸检测。《指南》同时明确,划定范围的核酸检测应在24小时内完成,以进一步提高疫情“早发现”能力。
3.新冠病毒抗原检测临时性纳入医保。为进一步加强新冠肺炎疫情防控医疗保障工作,国家医保局21日印发《关于切实做好当前疫情防控医疗保障工作的通知》,明确参保人在定点基层医疗机构发生的相关费用按统筹地区现行规定支付,在定点零售药店购买新冠病毒抗原检测试剂的费用,可使用个人账户支付。
评审动态
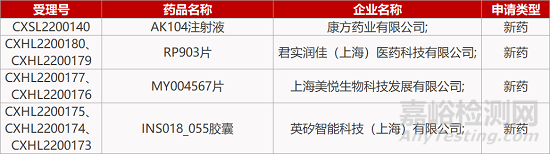
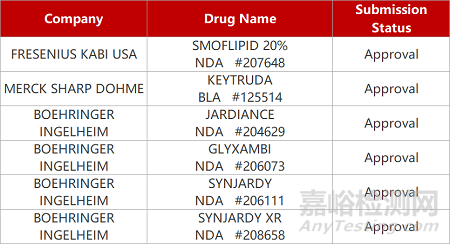
1. CDE新药受理情况(03月23日)

来源:药研发


