您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-26 13:42
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.盛世泰科ALK抑制剂在美获批临床。盛世泰科新一代ALK抑制剂CGT-9475获FDA临床默示许可。CGT-9475通过优质化和差异化的设计,旨在克服ALK阳性非小细胞肺癌(NSCLC)耐药性和中枢神经系统转移的难题,为NSCLC脑转移患者带来新希望。在临床前研究中,CGT-9475可同时抑制NSCLC细胞系中ALK、RET突变,并且具有良好的血脑屏障效果。今年6月,CDE已批准该新药进入临床试验。
2.绿叶乳腺癌缓释微球Ⅲ期临床积极。绿叶制药创新制剂注射用醋酸戈舍瑞林缓释微球(LY01005)在用于治疗乳腺癌的Ⅲ期临床达到预设终点。LY01005(3.6mg)每28天肌肉注射一次治疗可有效控制血清雌二醇至绝经后水平,临床疗效与对照药物相比达到非劣效标准。LY01005的安全性与对照药相似,而且LY01005无注射部位不良反应。
3.泽璟VEGF/TGF-β双抗获FDA临床许可。泽璟制药VEGF/TGF-β双功能抗体融合蛋白ZGGS18获FDA临床试验默示许可,拟用于实体瘤的治疗。临床前研究显示,ZGGS18在人非小细胞肺癌、结直肠癌等模型上具有显著的肿瘤抑制作用,而且与PD-1抗体联合用药也显示出协同增效作用。在国内,ZGGS18以治疗用生物制品1类新药申报的临床试验申请已获CDE受理。目前尚无同类药物在国内外获批上市或进入临床研究。
4.信达引进PDE4抑制剂获批临床。信达生物从UNION公司引进的下一代PDE4抑制剂orismilast缓释片获国家药监局多项临床试验默示许可,拟开发用于中重度特应性皮炎,以及适合系统性治疗和光治疗的中重度斑块型银屑病。根据ClinicalTrials网站,orismilast缓释片正在开展多项Ⅱ期临床,针对适应症包括中重度特应性皮炎、中重度斑块型银屑病、轻度至重度化脓性汗腺炎等。2021年11月,FDA已授予orismilast快速通道资格,用于治疗中重度特应性皮炎。
5.大睿生物与赛诺菲达成小核酸药物研发合作。大睿生物宣布与赛诺菲就小核酸管线和技术平台达成独家许可协议。根据协议,大睿生物将获得赛诺菲小核酸药物平台的化学修饰和递送平台的全球独家授权,以及四个未公开靶点的临床前候选药物。大睿生物将向赛诺菲支付预付款,研发和商业潜在里程碑付款以及产品净销售额分成。赛诺菲将拥有大睿平台开发的针对神经和肌肉候选药物在大中华区以外的独家授权。
国际药讯
1.塞利尼索获欧盟委员会扩展适应症。Karyopharm公司同类首创的口服核输出蛋白1(XPO1)抑制剂NEXPOVIO®(塞利尼索)获欧洲委员会(EC)扩展适应症,联合硼替佐米(Velcade®)和低剂量地塞米松(SVd),用于治疗既往接受过一种治疗的多发性骨髓瘤(MM)成年患者。在一项Ⅲ期临床中,与硼替佐米加地塞米松(Vd)方案相比,每周一次的SVd方案显示疾病进展或死亡风险显著降低。此前,该疗法联合地塞米松的方案已获批用于五线及以上治疗复发难治性MM患者。
2.杨森BCMA/CD3双抗获CHMP支持上市。欧洲药品管理局的人用药品委员会(CHMP)推荐有条件批准强生旗下杨森开发的BCMA/CD3双抗Tecvayli(teclistamab)上市,用于单药治疗复发或难治性多发性骨髓瘤(RRMM)。在一项Ⅰ/Ⅱ期临床中,中位随访约14.1个月时,患者的总缓解率为63%(95% CI:55.2-70.4),完全缓解率达到39.4%。该新药此前已获欧盟EMA授予优先药品资格;获FDA授予突破性疗法认定(BTD)。
3.阿斯利康/第一三共重磅ADC获优先审评资格。FDA受理阿斯利康与第一三共开发的HER2-ADC新药Enhertu用于治疗不可切除或转移性HER2低表达乳腺癌的补充生物制品许可申请(sBLA),并授予其优先审评资格,PDUFA日期预计在2022年第四季度。在III期DESTINY-Breast04试验中,Enhertu与化疗相比,患者的疾病进展或死亡风险显降低49%(HR=0.51,p<0.001);Enhertu组中位PFS为10.1个月(vs5.4个月),中位OS为23.4个月(vs16.8个月)。药物的安全性与之前的临床试验一致。
4.武田免疫调节新药Ⅲ期临床积极。武田皮下注射免疫球蛋白疗法HyQvia维持治疗慢性炎症性脱髓鞘性多发神经根神经病(CIDP)的Ⅲ期临床ADVANCE-1达到主要终点。在免疫球蛋白(IVIG)治疗背景下,HyQvia相比安慰剂可显著减少CIDP的复发(9.7%vs31.4%;p=0.0045);HyQvia总体安全性良好,大多数与治疗相关的不良事件均为轻度或中度。武田计划在今年内向FDA和EMA提交HyQvia的新药申请。
5.选择性雌激素受体降解剂获快速通道资格。FDA授予Olema Oncology公司口服小分子新药OP-1250快速通道资格,用于治疗ER+/HER2-的转移性乳腺癌。OP-1250是一款兼具完全雌激素受体拮抗剂(CERAN)和选择性雌激素受体降解剂(SERD)活性的潜在“best-in-class”内分泌治疗选择,能够有效且完全地抑制ER的活性,进而抑制ER驱动的乳腺癌细胞生长,并诱导ER降解。OP-1250目前正在临床中单药或联合哌柏西利治疗复发、局部进展或转移ER+/HER2-乳腺癌患者。
6.罗氏Tecentriq辅助治疗肾细胞癌III期临床失败。罗氏阿替利珠单抗(Tecentriq)用于肾癌辅助治疗的III期临床IMmotion010研究未达到主要终点。该试验旨在评估Tecentriq用于手术切除后高复发风险的肾细胞癌患者的辅助治疗的疗效。Tecentriq是全球首款获批上市的PD-L1单抗,目前获批的适应症主要包括尿路上皮癌、非小细胞肺癌、小细胞肺癌、三阴性乳腺癌、肝细胞癌和黑色素瘤。
7.CAMP4拟加速开发调节RNA靶向疗法。专注于遗传疾病开发反义寡核苷酸(ASO)精准疗法的CAMP4 Therapeutics宣布完成1亿美元的B轮融资。CAMP4的regRNA驱动平台能够在所有细胞种类中,发现与控制蛋白表达基因相关的regRNA图谱,并开发可编程的反义寡核苷酸(ASO)靶向这些regRNA,以协助基因的上调,最终达到治疗疾病的效果。此轮融资主要用于推进该公司Dravet综合征候选疗法在2023年中时进入临床阶段。
医药热点
评审动态
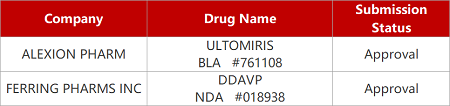
2. FDA新药获批情况(北美07月22日)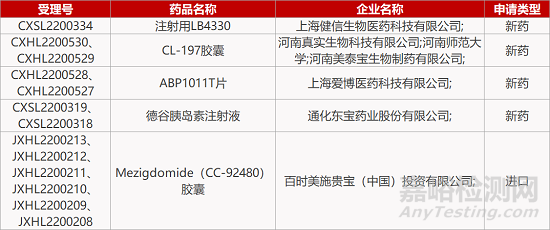

来源:药研发


