您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-27 11:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.复宏汉霖曲妥珠单抗在澳获批上市。澳大利亚药品管理局(TGA)批准复宏汉霖曲妥珠单抗生物类似药(商品名:汉曲优)上市,用于曲妥珠单抗原研药在澳大利亚获批的所有适应症,包括HER2阳性的早期乳腺癌;HER2阳性的局部晚期乳腺癌;HER2过表达的转移性乳腺癌;HER2阳性的晚期胃腺癌或胃食管交界腺癌。汉曲优是复宏汉霖按照中国、欧盟和美国等生物类似药法规研发的曲妥珠单抗生物类似药,已在欧盟和中国获批上市。目前该药的商业化网络已覆盖美国、加拿大、欧洲等90多个国家和地区。
2.志健金瑞不限癌种疗法国内获批临床。志健金瑞第二代RET抑制剂APS03118获CDE临床试验默示许可,拟用于RET阳性、不可切除的局部晚期或转移性实体瘤的治疗。APS03118通过选择性抑制RET蛋白,阻断RET蛋白下游的信号通路(包含RAS、MAPK、ERK、PI3K、AKT等),从而抑制肿瘤细胞增殖、迁移和分化。在美国,FDA已授予该新药快速通道资格,用于对选择性RET抑制剂耐药的转移性RET融合阳性非小细胞肺癌(NSCLC)患者。
3.再鼎引进FIC精神病新药获批临床。再鼎医药从Karuna公司引进的M1/M4型毒蕈碱激动剂KarXT胶囊获国家药监局临床试验默示许可,拟开发用于精神分裂症的治疗。KarXT与当前抗精神病药物与D2多巴胺受体结合的机制不同,它优先激活与精神分裂症和痴呆相关精神病性障碍等症状有关的中枢神经系统中的毒蕈碱受体,有望为患者提供一种新的治疗手段。该新药在海外已处于Ⅲ期临床开发阶段。
4.劲方TGF-β靶向抑制剂获批两项临床。劲方医药宣布其TGF-β R1抑制剂GFH018联用PD-1特瑞普利单抗的两项临床试验申请获得NMPA批准,一项为GFH018与特瑞普利单抗联用治疗晚期实体瘤患者的Ib/II期临床试验,该试验已于2021年10月在澳大利亚和中国台湾启动,目前已进入II期研究阶段;另一项则是GFH018与特瑞普利单抗联合同步放化疗治疗不可切除的局部晚期非小细胞肺癌的II期临床试验。目前,全球尚未有TGF-β R1抑制剂批准上市。
5.宜联生物实体瘤ADC获批临床。苏州宜联生物「注射用YL201」获国家药监局临床试验默示许可,拟用于晚期实体瘤的治疗。YL201是宜联生物基于其第4代ADC技术(高DAR值和中低毒素)开发的一款抗体偶联药物(ADC),以毒素连接子为创新结构。临床前数据显示,YL201可有效抑制多种肿瘤生长,且具有良好的耐受性。今年4月,该新药获FDA批准进入临床研究。
6.科伦又一款ADC海外授权。科伦药业宣布与默沙东达成研发合作和许可协议,默沙东将获得科伦一款实体瘤ADC药物在全球范围内进行研发、生产与商业化授权。双方还将对该款ADC药物的早期临床开发进行合作。根据协议,科伦将获得3500万美金首付款、不超过9.01亿美金的各类里程碑付款及相应净销售额提成。根据科伦管线推测,此次授权大概率为Claudin 18.2 ADC新药SKB315。值得一提的是,科伦今年5月已将TROP2-ADC药物SKB-264的海外授权许可给默沙东。
国际药讯
1.猴痘疫苗Imvanex在欧盟获批上市。欧盟委员会批准丹麦Bavarian Nordic公司生产的Imvanex疫苗上市,以应对猴痘疫情。Imvanex(MVA-BN,Jynneos)是Bavarian Nordic与美国政府合作开发的一种非复制型天花疫苗,已于2019年获FDA批准上市,用于在18岁以上的高危成年人群中预防天花(smallpox)和猴痘(monkeypox)感染。Jynneos是FDA批准的唯一一款非复制型天花疫苗,也是全球唯一获批的猴痘疫苗。
2.重症新冠口服药即将在英国获批。英国药品和保健品管理局(MHRA)支持加快审查Veru公司自主研发的口服微管蛋白抑制剂sabizabulin的上市许可申请,用于治疗中重度新冠住院患者的急性呼吸窘迫综合征。在一项III期临床中,sabizabulin较安慰剂将患者的死亡风险相对降低55%(死亡率:45%vs20%,p=0.0029)。今年6月,该新药已向FDA提交紧急使用授权申请(EUA),用于治疗中重度新冠住院患者。
3.艾伯维JAK抑制剂获欧盟批准用于结肠炎。欧盟委员会批准艾伯维口服抗炎药JAK1抑制剂RINVOQ®(乌帕替尼)用于治疗对传统药物治疗或生物制剂治疗应答不足、或不耐受的中重度活动性溃疡性结肠炎患者。在U-ACHIEVE和U-ACCOMPLISH诱导研究中,RINVOQ的临床缓解率为26%(vs5%)和33%(vs4%);在U-ACHIEVE维持治疗研究中,RINVOQ的临床缓解率分别为42%和52%,而安慰剂仅有12%。
4.大熊制药抗纤维化新药获FDA快速通道资格。大熊制药宣布自主开发的脯氨酰-tRNA合成酶(PRS)抑制剂新药DWN12088获FDA快速通道资格。DWN12088可减少影响胶原蛋白生成的PRS蛋白的影响,以抑制胶原蛋白的过度生成(导致纤维化的原因)。去年6月,FDA已批准该新药开展用于特发性肺纤维化的Ⅱ期临床研究。DWN12088也是韩国首款药物获得FDA快速通道资格。
5.拜耳Nubeqa治疗mHSPC最新数据积极。拜耳公布口服雄激素受体抑制剂Nubeqa联合多西他赛和雄激素剥夺疗法(ADT)治疗转移性激素敏感型前列腺癌(mHSPC)关键Ⅲ期ARASENS试验新的亚组分析数据。在预先指定的患者亚组中,与多西他赛+ADT相比,Nubeqa+多西他赛+ADT方案具有一致的OS益处,其中M1b和M1c亚组死亡风险分别降低33%(HR=0.66,95%CI:0.54-0.80)和21%(HR=0.76,95%CI:0.53-1.10);ALP<ULN、ALP≥ULN亚组的死亡风险分别降低36%(HR=0.65,95%CI:0.47-0.89)和31%(HR=0.69,95%CI:0.56-0.85)。两种方案治疗组的不良事件发生率相似。
6.Vertex公司布局体内碱基编辑疗法。Vertex公司与Verve Therapeutics将利用后者基于CRISPR系统改造的单碱基编辑技术平台,针对肝脏疾病合作开发基因疗法。合作项目的总金额最高可超过4亿美元。Verve公司主要产品VERVE-101日前在新西兰完成了首例患者给药,该疗法旨在通过在体内对PCSK9基因进行单碱基编辑,降低PCSK9表达和低密度脂蛋白胆固醇(LDL-C)水平。在临床前研究中,单次VERVE-101输注一年后将PCSK9水平降低89%,将LDL-C水平降低68%。
医药热点
1.沈洪兵任中国疾控中心主任。7月26日下午,中国疾控中心召开干部大会。国家卫健委党组成员、副主任,国家疾控局党组书记、局长王贺胜出席会议并宣布国家疾控局党组决定:沈洪兵同志任中国疾控中心主任、党委常委(兼),卢江同志任中国疾控中心党委书记、副主任(兼),周宇辉同志任中国疾控中心党委副书记,严俊同志任中国疾控中心党委副书记、纪委书记,刘剑君同志任中国疾控中心副主任、党委常委,再那吾东·玉山同志任中国疾控中心副主任。高福同志因年龄原因,不再担任中国疾控中心主任、党委常委。
2.上海:接种新冠疫苗有效降低死亡风险。7月25日召开的上海市新冠肺炎疫情防控新闻发布会上,在回答记者关于“患有慢性病的老年人不想接种新冠疫苗、还有的老人觉得自己不太出门没必要接种”的提问时,上海市疾控中心副主任孙晓冬表示,新冠疫苗对老年人的保护作用非常明显。对上海疫情数据的分析发现,未接种疫苗者发生死亡的风险分别是已接种1剂、2剂、3剂疫苗者的6倍、17倍、53倍。
3.跨省异地就医直接结算新政策出台。国家医保局会同财政部共同印发《关于进一步做好基本医疗保险跨省异地就医直接结算工作的通知》。《通知》要求,各地医保部门要及时调整与本通知不相符的政策措施,确保2022年12月底前同国家政策相衔接;结合本地实际,进一步明确和细化政策管理规定,精简办理材料,简化办理流程,优化管理服务。《基本医疗保险跨省异地就医直接结算经办规程》将于2023年1月1日起正式实施。
评审动态

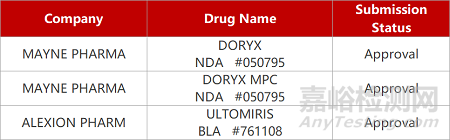

来源:药研发


