今日头条
中美瑞康ALS小核酸药获孤儿药认定。中美瑞康小核酸药物RAG-17获FDA授予孤儿药资格,用于治疗肌萎缩侧索硬化(ALS)。该公司专注于开发创新小核酸药物,自主开发智能化学辅助递送(SCAD™)系统和GOLD™递送技术,并拥有独立知识产权。RAG-17通过靶向SOD1以降低患者的SOD1蛋白表达,已在临床前研究中显示出能够显著延缓发病时间,延长动物的生存时间以及改善其运动功能。
国内药讯
1.安斯泰来Nectin-4靶向ADC在华报产。安斯泰来与Seagen公司开发的Nectin-4-ADC药物enfortumab vedotin(Padcev)的上市申请获国家药监局受理,拟用于治疗既往接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者。在EV-203研究(NCT04995419)中,IRC确认的ORR具有统计学意义,疗效和药代动力学数据与全球数据一致。在美国,Padcev的这一适应症补充上市申请(sBLA)已获得FDA优先审评,PDUFA日期定为2023年4月21日。
2.石药PD-1单抗报宫颈癌NDA。石药集团巨石生物抗PD-1单抗恩朗苏拜单抗注射液的上市申请获CDE受理,拟用于治疗至少一线含铂方案化疗失败的PD-L1表达阳性的复发或转移性宫颈癌患者。值得一提的是,该新药正在国内开展一项Ⅲ期临床,评价该药加含铂化疗联合/不联合贝伐珠单抗用于一线治疗PD-L1阳性复发或转移性宫颈癌患者的有效性和安全性。
3.贝达两款1类新药获批实体瘤临床。贝达药业两款1类新药BPB-101双抗注射液和BPI-472372分别获得国家药监局临床试验默示许可。BPB-101是一款三功能双特异性IgG1人源化抗体,拟开发用于标准治疗失败或无标准治疗的晚期实体瘤患者。BPI-472372是一款口服小分子CD73核苷酶抑制剂,拟开发治疗晚期恶性实体瘤(肺癌、胰腺癌、结直肠癌等)。
4.博锐NKG2A单抗获批实体瘤临床。博锐生物1类生物制品BRY805注射液获国家药监局临床试验默示许可,拟开发用于晚期实体肿瘤的治疗。BRY805是一种靶向自然杀伤细胞凝集素样受体亚家族C成员1(NKG2A)的单抗药物,可通过特异性结合NKG2A阻断HLA-E与NKG2A/CD94的结合,从而释放NK细胞的杀伤活性,起到抗肿瘤作用。目前尚未有同靶点药物获批上市。
5.广州慕恩活菌新药在美获批临床。慕恩生物自研活菌创新药MNO-863获FDA批准开展Ⅰ期临床试验,拟开发用于肥胖(BMI≥30kg/m²)的治疗。MNO-863旨在通过脑肠轴热量摄取控制、提升能量燃烧、增强糖脂代谢及调节肠道菌群与代谢物组成等多靶向创新型作用机理,以达到降低体重的目的。临床前研究显示,MNO-863单药四周后可使体重降幅约10%、并改善二型糖尿病与非酒精性脂肪肝炎,并具备较好的安全性。
国际药讯
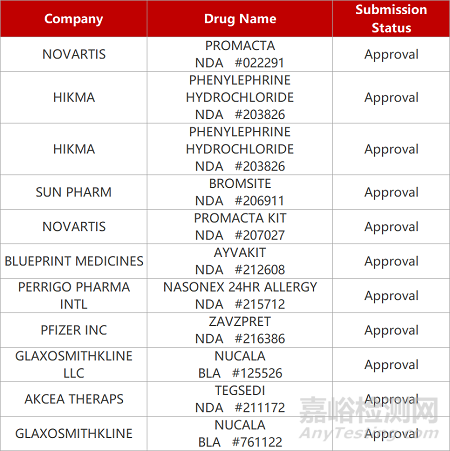
1.偏头痛CGRP拮抗剂鼻内喷剂获批上市。辉瑞与Biohaven公司开发的小分子CGRP拮抗剂Zavzpret(zavegepant)获FDA批准上市,用于偏头痛患者鼻内给药的急性治疗。该新药也是FDA批准用于这类患者的首款CGRP拮抗剂鼻内喷剂。在Ⅲ期临床中,zavegepant能够在15分钟快速起效;与安慰剂相比,zavegepant用药2小时后达到无痛(24%VS15%,p<0.0001)和无最烦人症状(40%VS31%,p=0.0012)的患者比例显著更高。
2.罗氏CD79b-ADC获FDA咨询委员会支持。罗氏CD79b-ADC药物Polivy(polatuzumab vedotin)获FDA肿瘤药物咨询委员会(ODAC)推荐批准新适应症,联合利妥昔单抗加环磷酰胺、多柔比星和泼尼松(R-CHP)治疗既往未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)患者,预计在4月2日前做出审评决定。在Ⅲ期临床POLARIX中,与标准治疗相比,Polivy+R-CHP组的疾病进展、复发或死亡风险降低27%(HR=0.73;95% CI,0.57-0.95;p<0.02)。
3.恩格列净报青少年糖尿病sNDA。勃林格殷格翰与礼来合作开发的口服SGLT2抑制剂恩格列净(Jardiance)的补充新药申请(sNDA)获FDA受理,联合饮食和运动降低10~17岁儿童及青少年2型糖尿病患者的血糖水平。在III期DINAMO研究中,与安慰剂相比,恩格列净治疗组第26周时患者HbA1c水平降低0.84%(P=0.012),空腹血糖水平也明显降低(-35.2 mg/dL; P = 0.0035);Jardiance的安全性与之前在2型糖尿病成人患者中的研究基本一致。
4.Mesoblast公司干细胞疗法在美报BLA。Mesoblast公司间充质干细胞疗法remestemcel-L的生物制品许可申请(BLA)获FDA受理,用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者,PDUFA日期为8月2日。Remestemcel-L可通过下调促炎细胞因子的产生、增加抗炎细胞因子的产生以及募集天然存在的抗炎至细胞至相关组织,从而抵消与SR-aGVHD相关的炎症反应。一项III期研究4年随访结果显示,患者的1年生存率为63%,2年生存率为51%。
5.K药联合化疗胸膜间皮瘤Ⅱ/Ⅲ期临床积极。默沙东抗PD-1抗体Keytruda联合化疗(培美曲塞与顺铂/卡铂)一线治疗晚期或转移性胸膜间皮瘤的Ⅱ/Ⅲ期临床(IND.227/KEYNOTE-483)达到主要终点。与安慰剂联合化疗相比,Keytruda联合化疗显著改善患者的总生存期;联合治疗的安全性与过往试验一致。恶性间皮瘤是一类起病于身体某些部位内壁的癌症,可能源自于胸部、腹部、心脏和睾丸。
6.阿斯利康PD-L1抗体肺癌III期研究成功。阿斯利康PD-L1抗体度伐利尤单抗(Imfinzi)新辅助/辅助治疗可切除的早期非小细胞肺癌(NSCLC)的III期AEGEAN研究最新结果积极。2022年6月,该研究已获得积极中期结果,Imfinzi联合化疗可显著改善患者病理学完全缓解(pCR)和主要病理缓解(MPR)。最新数据显示,与安慰剂相比,Imfinzi新辅助/辅助治疗显著延长患者的无事件生存期。
医药热点
1.国家医保局发布2022年医保事业发展统计快报。近日,国家医保局公布2022年医疗保障事业发展情况显示,截至2022年底,我国基本医保参保人数为134570万人,参保覆盖面稳定在95%以上。基本医保基金(含生育保险)总收入、总支出分别为30697.72亿元、24431.72亿元,年末基金累计结存达到42540.73亿元。在疫情防控方面,全年医保基金支付核酸检测费用43亿元。2021年至2022年,全国累计结算新冠病毒疫苗及接种费用1500余亿元。
2.福建首个儿童舒缓病房成立。3月10日,福建首个儿童舒缓病房在福州市第一医院成立。福州市第一医院儿童舒缓病房设在安宁疗护科和儿科,其中,安宁设有1个单间(1张床位),儿科设有2个单间、1个3人间(5张床位),共6张床位。儿童舒缓病房主要收治儿童肿瘤、罕见病等终末期患儿,或者需要止痛、镇静等对症治疗的儿童。
3.日本学者创造出有两个父亲的小鼠。日本大阪大学林克彦(Katsuhiko Hayashi) 教授在第三届人类基因组编辑国际峰会上宣布,他们使用雄性小鼠的细胞培育出了卵子,并且这些卵子可以与雄性精子受精,将其植入雌性小鼠体内,能够发育出健康、可育的后代。该项研究提供了早期概念验证,有望为不孕不育带来新治疗选择。
评审动态
1. CDE新药受理情况(03月11日)
2. FDA新药获批情况(北美03月09日)