今日头条
英矽智能USP1小分子抑制剂获批临床。英矽智能自主研发的USP1小分子抑制剂ISM3091已获得FDA批准,将在美国开展用于治疗实体瘤的Ⅰ期临床。ISM3091靶向调控DNA损伤和修复的“合成致死”靶点——USP1。在临床前研究中,ISM3091已在多个肿瘤细胞系中显示出潜在疗效,并在BRCA基因突变的肿瘤细胞、同源重组修复模型中具有强效的抗增殖活性。
国内药讯
1.强生CD38单抗中国获批新适应症。强生旗下杨森公司CD38单抗达雷妥尤单抗注射液(皮下注射)获国家药监局批准新适应症。达雷妥尤单抗皮下注射剂(英文商品名:Darzalex Faspro)是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方,可在大约3到5分钟内给药,与该产品静脉注射剂相比,能够将患者的给药时间从几小时缩短到几分钟。此前,该产品已在中国获批用于治疗原发性轻链型淀粉样变患者。
2.BI靶向IL-36R单抗中国报产。勃林格殷格翰2.2类新药佩索利单抗注射液(皮下注射)的上市申请获CDE受理。这是一款靶向白细胞介素-36受体(IL-36R)抗体药物,其静脉注射液已在中国获批用于治疗成人泛发性脓疱型银屑病(GPP)发作。与静脉注射治疗相比,皮下注射剂型使用更方便,患者可自行给药,有望提高用药依从性。
3.因明重组A型肉毒毒素Ⅱ期临床积极。因明生物宣布其控股企业重庆誉颜制药自主研发的注射用重组A型肉毒毒素YY001已在用于改善中重度眉间纹的Ⅰ/Ⅱ期临床试验获得安全性和有效性数据,正在积极准备Ⅲ期临床试验。YY001是由一种通过新型的重组蛋白生产途径生产的肉毒毒素,旨在解决从宿主肉毒杆菌提取天然肉毒毒素的生物安全问题。该产品具有高纯度、良好的安全性及生产可扩展性等多种优点。
4.邦耀自体HSC基因疗法早期临床积极。邦耀生物基因疗法BRL-101在ASGCT年会上公布针对输血依赖型β-地中海贫血,由研究者发起的临床研究(IIT)积极结果。数据显示,所有患者接受经基因编辑的造血干细胞(HSC)移植治疗后,红细胞数量和总体胎儿血红蛋白(HbF)水平显著上升,2/3患者在2个月内就脱离输血依赖,HbF达到正常范围。临床中清髓预处理相关毒性较轻,未发生与药物有关的严重感染等不良事件。
5.翰思艾泰CD47/PD-1双抗美国获批临床。翰思艾泰CD47/PD-1双特异性抗体HX009获FDA批准,即将在美国开展的Ⅰb/Ⅱ期临床研究,评估用于经标准治疗失败后复发/难治淋巴瘤患者中的疗效。在澳大利亚开展的Ⅰ期临床数据显示,HX009的客观缓解率(ORR)为15%;疾病控制率(DCR)为50%;而且临床中未观察到剂量限值性毒性及最大耐受剂量。2021年6月,该新药在国内用于实体瘤治疗的临床已进展至Ⅱ期临床阶段。
6.辉瑞CGRP拮抗剂中国获批偏头痛临床。辉瑞1类化药“zavegepant鼻喷雾剂”获国家药监局临床试验默示许可,拟开发用于成人偏头痛的急性期治疗(有或无先兆)。zavegepant是一款CGRP受体拮抗剂,今年3月已获FDA批准上市,用于急性治疗偏头痛成人患者。在Ⅲ期临床中,zavegepant能够在15分钟快速起效;与安慰剂相比,zavegepant用药2小时后达到无痛(24%VS15%,p<0.0001)和无最烦人症状(40%VS31%,p=0.0012)的患者比例显著更高。
7.映恩HER3靶向ADC获批实体瘤临床。映恩生物1类生物制品“注射用DB-1310”临床试验申请获国家药监局临床试验默示许可,拟用于治疗晚期/转移性实体瘤。DB-1310是一款靶向HER3的ADC产品,由新型人源化抗Her3单克隆抗体通过马来酰亚胺可裂解linker与专有的DNA拓扑异构酶I抑制剂共价连接,DAR值约为8。在临床前研究中,DB-1310显示出积极的肿瘤抑制效果和安全性;并与EGFR小分子抑制剂联合治疗具有协调治疗效果。
8.荣昌生物首款双抗报IND。荣昌生物自主研发的1类生物制品“RC148注射液”临床试验申请获CDE受理。RC148注射液是荣昌首款申报临床的双抗药物,靶点尚未公布,拟用于治疗实体瘤。据悉,荣昌生物已建立包括抗体和融合蛋白平台、抗体-药物偶联物(ADC)平台和双功能抗体(HiBody)平在内的三个专业平台;已布局有5款双特异性抗体,其中RC218和RC228这两款双抗针对眼科疾病。
国际药讯
1.礼来口服GLP-1R激动剂启动减肥III期临床。礼来非肽类口服GLP-1R激动Orforglipron(LY3502970)在clinicaltrials.gov网站上登记启动一项III期临床(ATTAIN-1),评估用于治疗伴有体重相关合并症的成人肥胖或超重患者的疗效和安全性。公布于EASD2022年会上的I期临床结果显示,LY3502970组患者糖化血红蛋白水平(HbA1c)降幅1.5%~1.8%(安慰剂组降幅0.4%),减重1.6~5kg(安慰剂组体重增加0.5kg)。今年4月,LY3502970已启动用于治疗2型糖尿病的III期临床(ACHIEVE-4)。
2.罕见病基因疗法获再生医学先进疗法认定。REGENXBIO公司一次性基因疗法RGX-121获FDA授予再生医学先进疗法认定(RMAT),用于治疗II型黏多糖贮积症(MPS II)。RGX-121旨在使用AAV9载体将编码I2S酶的人艾杜糖酸-2-硫酸酯酶(IDS)基因递送至中枢神经系统(CNS),以达到纠正或修复周围细胞的遗传缺陷或功能异常。该公司计划明年向FDA递交RGX-121的生物制品许可申请。
3.LAG-3组合疗法肺癌早期临床积极。Immutep公司LAG-3融合蛋白eftilagimod alpha(efti)与PD-1抗体Keytruda、和双联化疗(卡铂/培美曲塞)构成的三联组合疗法,在一项由研究者发起的针对晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的Ⅰ期临床获积极结果。数据显示,三联组合疗法达到67%的总缓解率(ORR)和91%的疾病控制率(DCR);在PD-L1表达评分<50%的患者群体中,ORR达到65%。
4.阿斯利康心肌病单抗早期临床积极。阿斯利康旗下公司Alexion与Neurimmune公司合作开发的人源化单抗药物NI006在治疗转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)的Ⅰ期临床获积极结果。NI006旨在特异性靶向错误折叠的转甲状腺素蛋白,以清除心脏中的淀粉样纤维沉积物。12个月治疗数据显示,NI006显著减少患者心脏淀粉样蛋白沉积;未观察到明显的剂量限制性毒性或与药物相关的严重不良反应。
5.罗氏终止TAAR1激动剂II期临床。罗氏日前终止其在研痕量胺相关受体1(TAAR1)激动剂ralmitaront治疗精神分裂症或分裂情感障碍阴性症状患者的II期(NCT03669640)临床试验。中期分析显示,与安慰剂相比,ralmitaront不太可能达到主要终点。去年罗氏也终止了该药物的一项II期研究,旨在评估ralmitaront单药治疗精神分裂症或分裂情感障碍急性加重患者的疗效。
6.Pyxis Oncology完善ADC技术平台。Pyxis Oncology宣布将以总交易金额约1600万美元收购Apexigen,并获得Apexigen兔单克隆抗体和突变谱系引导人源化技术抗体药物发现平台APXiMAB™,进一步完善其抗体偶联药物技术平台(FACT ADC toolkit),以推进PYX-201和 PYX-106的开发。通过收购,Pyxis Oncology还将获得Apexigen在研CD40激动剂Sotigalimab。Sotigalimab联合纳武利尤单抗在抗PD-(L)1难治性黑色素瘤患者中已取得积极结果,更新数据将在ASCO2023年会上公布。
医药热点
1.国家医疗队巡回医疗即将展开。国家卫健委办公厅发布《关于开展2023年国家医疗队巡回医疗工作的通知》指出,将以医疗服务能力薄弱地区为重点,组织2023年的国家医疗队巡回医疗工作;组队医院包括北京协和医院等16家医院,派出时间为6月—10月。《通知》明确,每支国家医疗队不少于5人,以副高及以上职称的医务人员为主;工作时间不少于3周,其中在县域开展工作的时间不少于2周。
2.陈德昌教授当选中华医学会重症医学分会主任委员。5月23日,中华医学会重症医学分会换届选举大会在天津举行,会议选举产生了中华医学会重症医学分会第六届委员会,上海交通大学医学院附属瑞金医院重症医学科主任陈德昌教授当选中华医学会重症医学分会第六届委员会主任委员。
3.卫健委回应医学专硕与住院医师同工同酬。针对网民关于“临床医学硕士专业研究生与住院医师同工同酬”的建议,国家卫健委近日作出回复表示,根据7部门《关于建立住院医师规范化培训制度的指导意见》规定,临床医学硕士专业学位研究生属于学生身份,接受教育行政部门和有关高校的管理,学习期间执行研究生教育有关规定,享受研究生有关待遇。
评审动态
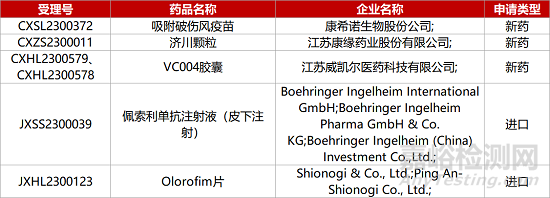
1. CDE新药受理情况(05月25日)
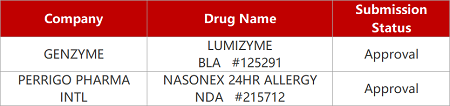
2. FDA新药获批情况(北美05月24日)