您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-22 12:06
近日,经国家药品监督管理局(NMPA)批准,乐普(北京)医疗器械股份有限公司研发的适用于外周血管的 PeakSheath™一次性使用血管鞘成功取得中华人民共和国医疗器械注册证,注册证编号:京械注准20242030402。
产品适用范围:一次性使用血管鞘用于经皮穿刺插入血管系统,导入导丝、导管等医疗器械。
说起血管鞘,介入科的医生再熟悉不过。血管鞘相当于一台介入手术的基础,帮助医生建立一条治疗“轨道”,保证后续的“运输”工作顺利进行。
一次性使用血管鞘被设计用于经皮穿刺插入血管系统,导入造影导管、导引导管、球囊扩张导管或支架,进行介入诊断或治疗手术,血管鞘具有一侧边连通接口,可在术中抽取血样、压力监测、注入扩血管药物或造影剂;适用于需要经皮插入血管内器械的动脉和静脉手术。
乐普医疗 PeakSheath™一次性使用血管鞘的推出,为介入手术中通路维持、血管造影和器械输送提供保障。让医生操作更方便,让患者接受治疗更安全。
PeakSheath™一次性使用血管鞘
产品特点:
适用范围广泛,涵盖颈动脉、肾动脉、髂动脉、股浅动脉和膝下动脉等外周血管;
不锈钢弹簧缠绕结构,管身兼具支撑性、柔顺性、显影性;

采用超薄壁技术增大内径,内外径参数优于同类产品;

规格型号齐全,涵盖5种弯型、4F-12F不同直径的规格型号

市场规模
根据《中国心血管健康与疾病报告2022》数据显示,我国心血管病现患人数3.3亿,其中脑卒中、冠心病分别为1300万、1139万人。由导管鞘建立手术通路是心血管手术成功操作的前提条件,我国心血管病患者规模扩大,为导管鞘市场带来了广阔发展空间。
据贝哲斯咨询发布的一次性血管鞘市场调研报告,全球一次性血管鞘市场规模在2023年达到 58.03 亿元人民币。预计至2029年,全球一次性血管鞘市场规模将会达到 91.97亿元,以 6.90% 的复合年增长率增长。
我国获得有效注册证的血管鞘产品也在不断增加,根据国家药监局信息显示,截至2024年8月20日,已获批的进口血管鞘产品主要企业包括泰尔茂、费森尤斯、爱德华生命科学、爱琅医疗、库克等。
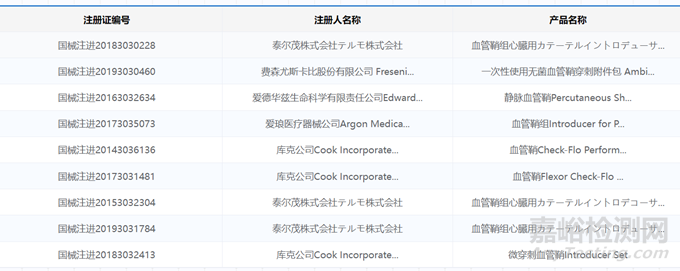
▲已获批的进口血管鞘产品
我国血管鞘相关企业较多,包括乐普医疗、南京脉创医疗、苏州美创医疗、上海瑛泰医疗、杭州诺生医疗、湖南埃普特医疗、北京迪玛克等,此前已获批的国产血管鞘产品有27件,其中一次性血管鞘产品有4件,部分如下图所示。
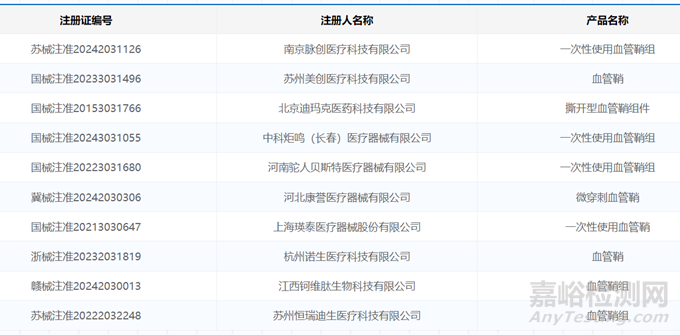
▲已获批的部分国产血管鞘产品
乐普医疗

乐普(北京)医疗器械股份有限公司(简称“乐普医疗”)创立于1999年,2009年成功在深交所A股创业板上市(300003.SZ),是我国最早从事心脏介入医疗器械研发制造的企业之一,主营业务覆盖医疗器械、药品、医疗服务及健康管理三大板块。旗下自主研发的产品包括生物可吸收支架、切割球囊、药物球囊、可降解封堵器、TAVR瓣膜、人工智能心电自动分析诊断系统等。
2022年11月,乐普医疗旗下主营结构性心脏病创新产品的乐普心泰医疗科技股份有限公司(简称“心泰医疗”)在港交所上市。
2024年一季度,乐普医疗实现营收19.22亿元,同比下降21.14%;实现归属净利润4.82亿元,同比下降19.27%。乐普医疗提到,今年一季度营收同比下降的主要原因是,去年仍有部分应急产品销售,且集中在一季度。
展望后市,乐普医疗的管理层比较乐观,该公司预期2024年全年实现营收85亿元-90亿元,实现净利润20亿元-22.5亿元。

来源:心未来


