您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-01 22:47
体外经皮起搏器适用于体外经皮起搏产品,可进行体外经皮起搏治疗,按照《医疗器械分类目录》,产品的管理类别为Ⅲ类,是用于心脏的治疗、急救装置。
一、体外经皮起搏器的结构
包含但不限于:主机、部件和附件的名称、型号和制造商(Legal Manufacture)。这些信息同时应以注册申请表附页形式给出,例如表1。
表1. 产品结构及组成的附页(示例)
|
名称 |
型号 |
制造商 |
|
主机 |
α |
κ 医疗电子股份有限公司 |
|
经皮起搏功能模块 |
β |
λ Medical Systems |
|
可重复使用起搏电极 |
γ |
μ Medical Corporation |
|
起搏电缆线 |
δ |
ν GmbH |
|
一次性使用起搏电极片 |
ε |
ξ 株式会社 |
|
…… |
… |
…… |
|
电池 |
θ |
…… |
|
交流电源适配器 |
ι |
ρ …… |
|
PC软件 |
软件组件的名称、发布版本 |
|
二、体外经皮起搏器的研发实验要求
1.产品性能研究
产品的现行有效标准如下:
GB 9706.1-2007 医用电气设备 第1部分:安全通用要求;
GB 9706.15-2008 医用电气设备 第1-1部分:通用安全要求 并列标准:医用电气系统安全要求(如适用);
YY 0505-2012 医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容要求和试验;
YY 0709-2009 医用电气设备 第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南(如适用);
YY 0945.2-2015 医用电气设备 第2部分:带内部电源的体外心脏起搏器安全专用要求;
YY/T 0196-2005 一次性使用心电电极(如适用)。
应当进行产品性能研究,包括性能指标、质量控制相关指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
1.1 感知器的关键技术特点及其性能指标
应明确产品的治疗模式,例如,按需起搏模式、固定起搏模式等。
应说明感知器的工作原理和应用方式,明确感知器的性能指标,例如,各起搏模式的起搏频率和最大跟踪频率、正负极的灵敏度、脉冲不应期、感知不应期等。
1.2 经皮起搏治疗的关键技术特点及其性能指标
应明确各起搏模式下的功能和性能指标,例如,起搏波形、起搏频率、电源等方面的功能和性能指标。
对于起搏模式(固定起搏模式、按需起搏模式等),应进行固定起搏模式的起搏频率准确性验证,出具按需起搏模式的性能研究资料。
应明确起搏波形及其详细指标,例如,脉冲形态(方型脉冲、衰减型脉冲等)、脉冲宽度(宽脉冲时间、窄脉冲时间等),上述指标可形成多种起搏波形,例如,宽脉冲时间的方型起搏波形、窄脉冲时间的衰减型起搏波形、窄脉冲时间的方型起搏波形等,并且至少明确下述性能指标:
对于方型脉冲,应明确脉冲幅度、脉冲宽度等;对于衰减型脉冲,注册申请人应明确峰值电流、平均电流、相对峰值电流的电流衰减比例、波形斜率(上升沿、下降沿)、脉冲宽度等。
按照电流-时间关系,注册申请人应绘制起搏波形释放的脉冲图,并针对波形特点给出波形详细指标。
1.3关键元器件及其质量控制要求
应出具产品的工作原理图、产品总体设计方案和总体设计框图,应简述体外经皮起搏各单元模块的功能及相互关系,应明确感知器、经皮起搏脉冲发生器等单元模块及其设计要求。
基于风险分析和管理、验证和确认等的工作,注册申请人应确定下述模块(包括但不限于)相关器件是否为关键元器件,并明确关键元器件的名称、型号、规格、制造商以及需要控制的规格参数和性能指标:
1.3.1电源模块,例如,电源适配器、电池、电源模块等;
1.3.2控制模块,例如,硬件电路的MCU、扩展资源、通信电路等;
1.3.3测量模块,例如,信号采集和转化电路等;
1.3.4充电模块,例如,充电电容、充电高压管、充电变压器等;
1.3.5放电模块,例如,放电桥中电子开关等;
1.3.6监护附件,例如,心电监护电极、心电导联线;
1.3.7治疗附件,例如,可重复使用起搏电极、一次性使用起搏电极片等。
2.生物相容性评价研究
应对预期与人体接触附件进行生物相容性评价,例如,可重复使用起搏电极、一次性使用起搏电极片以及其他配合使用的附件,应给出细胞毒性、致敏、刺激或皮内反应项目的生物相容性评价资料。
宜参考的现行有效标准有:
GB/T 16886.1-2011 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验;
GB/T 16886.5-2003 医疗器械生物学评价 第5部分:体外细胞毒性试验;
GB/T 16886.10-2005 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验;
GB/T 16886.12-2005 医疗器械生物学评价 第12部分:样品制备与参照样品;
GB/T 16886.18-2011 医疗器械生物学评价 第18部分:材料化学表征;
GB/T 14233.2-2005 医用输液、输血、注射器具检验方法 第2部分:生物学试验方法。
宜参考GB/T 16886.1-2011评定程序的框架并且在风险分析和管理的基础上,根据产品与人体接触性质、接触时间和接触周期,考虑生物学评价项目,并按照图1进行生物学评价。
生物相容性评价研究应当包括:
1.生物相容性评价的依据和方法;
2.产品所用材料的描述及与人体接触的性质;
3.实施或豁免生物学试验的理由和论证;
4.对于现有数据或试验结果的评价。
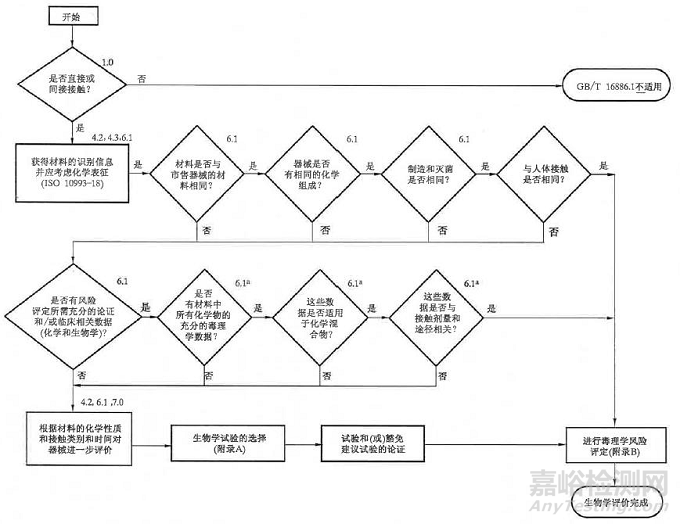
图1. 生物学评价的系统方法框图
对于已获得注册批准上市的附件,在GB/T 16886.1-2011的4.7项中任一情况下,注册申请人应重新评价材料或最终产品的生物相容性。
如果已获得注册批准上市的附件未发生GB/T 16886.1-2011中4.7项的情况,注册申请人应出具其制造商做出的未发生GB/T 16886.1-2011的4.7项所规定的重新评价情况的声明,并且应给出该附件的医疗器械注册证复印件及其原生物学评价资料的复印件。
3.产品有效期和包装研究
3.1应明确产品的预期使用寿命,按照《有源医疗器械使用期限注册技术审查指导原则》给出预期使用寿命的分析验证报告。
3.2应明确非可充电电池和一次性使用起搏电极片的有效期,并给出有效期的验证报告。
3.3应进行可重复使用起搏电极的使用次数验证。
3.4应出具在宣称的有效期内以及运输储存条件下,保持包装完整性的依据,可参考GB/T 4857系列标准、International Safe Transit Association (ISTA) 1, 2, 3, 7 SERIES、ISO 4180 Packaging、ASTM D4169 D7386 F2825等。
4.软件研究
产品所含的软件组件一般不宜单独注册。按照《医疗器械软件注册技术审查指导原则》,应按照C级安全性级别出具软件描述文档;按照《医疗器械网络安全注册技术审查指导原则》,应根据产品网络安全的具体情况出具网络安全描述文档或常规安全补丁描述文档。
三、相关标准
1.《医疗器械监督管理条例》(国务院令第650号)。
2.《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)。
3.《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局与中华人民共和国国家卫生和计划生育委员会令第25号)。
4.《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)。
5.GB 9706.1-2007 医用电气设备 第1部分:安全通用要求。
6.GB 9706.8-2009 医用电气设备 第2-4部分:心脏除颤器安全专用要求。
7.GB 18279-2000 医疗器械 环氧乙烷灭菌 确认和常规控制。
8.GB 18280-2000 医疗保健产品灭菌 确认和常规控制要求 辐照灭菌。
9.GB/T 14710-2009 医用电器环境要求及试验方法。
10.YY 0505-2012 医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验。
11.YY/T 0287-2003 医疗器械 质量管理体系 用于法规的要求。
12.YY/T 0316-2008 医疗器械风险管理对医疗器械的应用。
13.《医疗器械注册申报资料要求和批准证明文件格式》(国家食品药品监督管理总局公告2014年第43号)。
14.《食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知》(食药监械管〔2015〕247号)。
15.《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)。
16.《药物临床试验的生物统计学指导原则》(国家食品药品监督管理总局通告2016年第93号)。
17.《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告2014年第9号)。
18.《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局2015年第50号)。
19.《医疗器械生物学评价和审查指南》(国家食品药品监督管理局 国食药监械〔2007〕345号通知)。
20.《无源植入性医疗器械货架寿命申报资料指导原则》。
四、主要风险
制造商应按照YY/T 0316-2008《医疗器械风险管理对医疗器械的应用》附录C提示的问题,对照产品的实际情况作针对性的简明描述。
表2. 危害示例、危害、可预见的事件序列、危害处境和损害之间的关系
|
危害分类 |
危害二级分类 |
危害示例 |
可预见的事件序列 |
危害处境 |
损害 |
|
能量危害 |
电磁能 |
网电源、电池 |
电池电量低或退化 |
最大充电电流变小,充电超时 |
延误治疗 |
|
|
PCBA污染、器件老化引起的开机电路电气特性退化。 |
延误治疗 |
|||
|
|
电池包缺乏过温保护设计。 |
延误治疗 |
|||
|
|
由于负载电路或电池包内部电路发生短路,导致电芯过载发热。 |
延误治疗 |
|||
|
|
电池电量低条件下开机,且未能及时连接外部电源。 |
延误治疗 |
|||
|
|
电池充放电老化或寿命到期 。 |
延误治疗 |
|||
|
|
电池电量耗费过快。 |
延误治疗 |
|||
|
漏电流(外壳漏电流、对地漏电流、患者漏电流) |
|
在边界温湿条件下,高压电容漏电过大。 |
错误的能量释放,紧急情况下导致死亡 |
||
|
电场、磁场 |
|
放电控制电路中开关受外科手术设备的电磁干扰,导致错误放电。 |
操作者可能被电击 |
||
|
能量 |
在患者和电极片之前产生的高压电对操作者和患者带来危害 |
|
操作者和患者可能被电击 |
||
|
对患者进行电复律后,引起患者室颤/室速 |
|
|
|||
|
辐射能 |
非电离辐射 |
|
|
|
|
|
热能 |
高温 |
|
长期高温条件下存贮,导致电芯超出其使用温度环境条件。 |
延误治疗 |
|
|
低温 |
|
电池电量耗费过快。 |
延误治疗 |
||
|
|
热能伤害 |
|
患者和操作者皮肤灼伤 |
||
|
机械能 |
重力(坠落、悬挂物) |
|
当设备悬挂时,本身重力或意外挤压设备,使背插的电池包受外力挤压或穿刺;产生电气不良 |
延误治疗 |
|
|
振动 |
|
振动等引起的按键颤动、意外按键引起的误触发开机,误触发放电等。 |
延误治疗;操作者可能被电击 |
||
|
|
电芯点焊条件超出电芯供应商的典型制造规格,在存在振动等机械应力的条件下,没有足够的焊接强度而松脱 |
延误治疗 |
|||
|
|
振动导致的电气接触不良:电池包连接器插座与设备匹配的插头不充分的连接,电池插针变形。 |
延误治疗 |
|||
|
生物学和化学危害 |
生物学危害 |
细菌:重复使用附件未经严格消毒或灭菌感染细菌的危害 |
|
|
|
|
再次或交叉感染:重复使用附件未经严格消毒或灭菌而交叉感染的危害 |
|
|
|
||
|
化学 危害 |
患者组织暴露于外来材料中:加工残留物、污染物、添加剂或加工助剂、清洗与消毒试剂残留物、降解或析出物等 |
|
|
|
|
|
生物 相容性危害 |
与患者接触附件的生物相容性方面的危害(细胞毒性、致敏、刺激或皮内反应) |
|
|
|
|
|
操作危害 |
功能 |
不正确或不适当的输出或功能 |
进行无意的放电而造成的危害 |
|
操作者和旁观者可能被电击 |
|
起搏波形释放不足 |
|
起搏失败 |
|||
|
电极板材料有亲水性 |
在患者、治疗电极与使用者间形成电流通路。 |
延误患者治疗,紧急情况下导致死亡 |
|||
|
|
治疗模块放电控制电路重复性与一致性设计不足。 |
错误的能量释放,紧急情况下导致死亡 |
|||
|
外部电极板连接装置缺陷 |
放电阻抗发生瞬间变化,释放的能量远小于设定的能量。 |
错误的能量释放,紧急情况下导致死亡 |
|||
|
附件贴合不紧密 |
导电性能下降,阻抗增大 |
错误的能量释放,紧急情况下导致死亡 |
|||
|
不正确的测量 |
病人阻抗测量不正确 |
错误的病人阻抗检测导致放电能量级偏高。 |
错误的能量释放,紧急情况下导致死亡 |
||
|
能量测量和显示不正确 |
|
错误的能量释放,紧急情况下导致死亡 |
|||
|
功能的丧失或变坏 |
关键元器件的性能丧失或降低 |
充电过程与充电结束的状态指示不清楚。 电源保护导致无法充电。 系统绝缘问题或器件问题。 储能电容在不同工作电压下的性能不满足要求,如高压时的漏电流增加。充电超时。 高压电容,高压器件寿命提前终止。 |
延误治疗 |
||
|
充放电控制失效:高压电容电压检测错误。 |
错误的能量释放,紧急情况下导致死亡 |
||||
|
自检功能丧失或降低 |
自检时对系统的当前状态信息进行了清除。 |
延误治疗 |
|||
|
自检项目中没有可充电电池电量,且自检信息覆盖了机器状态信息。 |
|||||
|
系统自检功能缺乏在不同工作模式下的不同检测内容调整,或工作状态下自检不执行。 |
|||||
|
自检动作不能手动取消。 |
|||||
|
软件设计缺陷或错误 |
放电时机不对 |
患者可能被延误治疗;操作者可能被电击 |
|||
|
能量检测电路或算法缺陷。 |
错误的能量释放,紧急情况下导致死亡 |
||||
|
无运动检测功能,或运动检测与抑制能力不足 |
不能及时救治患者或错误救治患者,严重导致死亡 |
||||
|
软件设置不正确。 |
|||||
|
不能检出并抑制双波峰起搏信号 |
|||||
|
心电信号被中频信号干扰,错误分析心电节律为心室停止。 |
|||||
|
使用 错误 |
不遵守规则 |
未及时校准 |
|
|
|
|
未及时更换易损易耗部件 |
|
|
|||
|
清洗消毒不及时 |
|
|
|||
|
错误的使用环境 |
产品被误用于磁共振环境 |
功能失效,延误治疗 |
|||
|
在富氧环境,或存在可燃性麻醉气体的环境中使用 |
着火 |
||||
|
缺乏知识 |
|
不正确的治疗操作。(比如不符合高级心脏生命支持) |
延误患者治疗,紧急情况下导致死亡 |
||
|
|
|
使用多功能电极板时,控制面板放电键被使能并被误操作。 |
操作者可能被电击 |
||
|
|
设备浸水,电气安全降低。 |
延误患者治疗,紧急情况下导致死亡 |
|||
|
|
电极板等在操作中可能受力的部件、接缝产生开裂。 |
延误患者治疗,紧急情况下导致死亡 |
|||
|
|
导电膏未均匀涂敷在电极板按压面、放电板相互接触或接近心电监护电极,电极片或电极板金属面与病人皮肤间存在间隙性接触,高压放电时产生了电弧。 |
病人皮肤烧伤。 |
|||
|
模式或参数设置不当 |
能量手动设置错误。 |
错误的能量释放,紧急情况下导致死亡 |
|||
|
信息危害 |
标记和说明 |
使用说明书不完整 |
|
功能操作步骤复杂,没有操作说明标识或提示。 |
延误治疗 |
|
性能指标描述不恰当 |
|
|
|
||
|
预期用途规定不适当 |
|
|
|
||
|
使用限制条件说明不充分 |
|
|
|
||
|
操作 说明 |
与产品一起使用的附件规定不充分 |
|
|
|
|
|
使用前检查规定不充分 |
|
|
|
||
|
操作指示过于复杂 |
|
|
|
||
|
警告 |
副作用的警告 |
|
|
|
|
|
一次性附件可能被错误地再次使用的危害 |
|
|
|
||
|
其他关于安全使用产品的警告 |
|
|
|
||
|
服务 和维护规格 |
服务和维护周期定义不当 |
|
|
|

来源:嘉峪检测网


