您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-09 11:51
4C Medical Technologies, Inc.(“4C Medical”)是一家致力于推进结构性心脏病微创治疗的医疗科技公司,其宣布,用于经导管二尖瓣置换(TMVR)设备AltaValve™系统已获得美国食品和药物管理局(FDA)授予的突破性设备称号,该突破性设备认证加快了审查过程,缩短了获得FDA批准后到达患者手中的时间。

具体而言,FDA授予AltaValve系统突破性设备称号,用于两种治疗适应症:
治疗中度至重度或重度二尖瓣反流 (MR),以及
治疗伴有中度/重度二尖瓣环钙化 (MAC) 的中度至重度或重度 MR。
每次左心室收缩时,血液都会通过二尖瓣回流并流入心房,就会发生 MR。如果不及时治疗,MR可导致心力衰竭或死亡。由于二尖瓣解剖结构的复杂性和该患者群体中通常存在的合并症,临床医生及其患者可获得的药物治疗有限。
扩大可治疗的患者群体
包括心内直视手术高风险的原发性和继发性二尖瓣反流患者
仅心房固定位于自体二尖瓣上方,可确保关键的心脏结构保留在左心室内
AltaValve 旨在最大限度地减少其他 TMVR 技术有时发现的并发症,例如设备栓塞、左心室流出道 (LVOT) 梗阻、左心室功能障碍(例如腱索破裂)等。
AltaValve的支架使未来左心房通路可用于其他手术
AltaValve 是唯一一款用于治疗既往瓣膜修复患者的设备
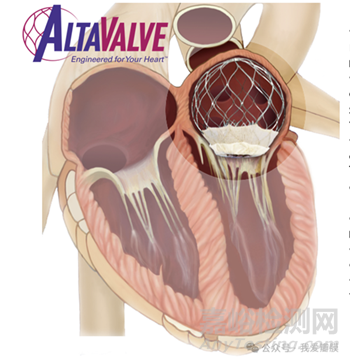
即使在完全部署后,AltaValve 也可以重新组装,从而提高程序安全性*
人工瓣膜在部署后数秒即可完全发挥作用,确保患者的血流动力学稳定性
TS 输送系统提供可控的可控可操作性,可适应各种解剖结构

4C Medical创始人兼首席医疗官Jeff Chambers博士表示:“AltaValve系统提供了一种新颖的经导管治疗选择,以满足不适合手术或经导管边缘到边缘修复的患者未满足的临床需求。该技术的仅心房固定旨在最大限度地减少与锚定二尖瓣环相关的复杂性和可变性,这种差异化的方法保留了关键的心脏结构,降低了左心室流出道梗阻或左心室损伤的风险。
到目前为止,AltaValve在4C Medical的早期可行性研究(NCT03997305)中接受治疗的患者中取得了良好的结果。这些数据表明,AltaValve系统是一个很有前途的选择,在大多数患者中显示出很高的手术成功率,并在30天内完全消除MR,4C Medical 预计将于 2024 年晚些时候开始对 AltaValve 系统进行全球 Pivotal 试验,以支持 CE 标志和 FDA 批准。
4C Medical首席执行官兼总裁Saravana Kumar表示:“AltaValve系统的双重突破性认定是4C Medical临床项目的一个重要里程碑,我们很高兴在即将到来的AltaValve Pivotal试验中评估这两个适应症。“这一进步使我们能够有机会更快地将这种所需的技术带给我们的患者。”
关于4C Medical Technologies, Inc.

4C Medical处于医疗器械创新的最前沿,专注于开发结构性心脏病的变革性技术,最初针对二尖瓣反流(MR)治疗,随后扩展到三尖瓣反流治疗。AltaValve 系统代表了 MR 治疗的范式转变,其仅心房固定。通过保留自体二尖瓣和左心室,它最大限度地减少了与传统经导管二尖瓣置换技术相关的挑战,这些技术依赖于在自体二尖瓣环和左心室中的放置和固定。
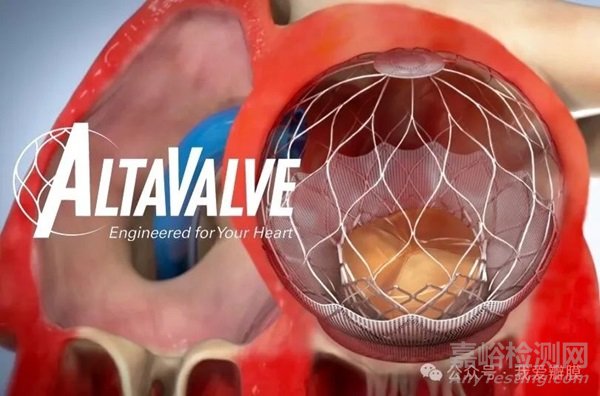

来源:我爱瓣膜


