您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-29 08:38
了解药品研发中的质量源于设计(QBD)理念,首先需要了解几个概念:目标质量概况(QTTP),关键质量属性(CQAs),过程控制(PAT),试验设计(DOE)。这几个因素相互关联,环环相扣于整个药品研发中。
由最初的质量源于检测,到质量源于控制,再到质量源于设计,体现了药品研发对各方向把握及对产品质量的了解的深入。
质量源于设计,体现在整个研发系统中,从原辅料的质量及关键性质控制到工艺输入物料性质及工艺参数的控制及放大生产。与传统单一定点研发思路相比,QbD调控的空间较大,产品质量发生偏差时,能及时知道原因并修正,通过小试筛选的工艺范围,能有效为放大提供依据。
QBD在药物中研发思路如下:
一、 研发初始立项调研影响QTTP要素分析
了解产品的QTTP,其中除了传统的制剂一般质量属性外,还应该特别关注其给药剂量及方式与药代动力学方面的文献资料数据。充分了解哪些性质可能影响药物吸收,该药物吸收情况如何。吸收部位是胃,还是肠道,作用是局部还是全身。这些因素可能都会影响BE试验结果。
与此相关,除了药物本身药代动力学性质外,还应该调研影响药物吸收的辅料可能的作用方式,这里不仅限于调查辅料本身对吸收是否有影响,还应该注意辅料中某些残留物或分解物可能对吸收造成影响,在此应列入QBD考察的辅料CQAs范围,特别是一些用量大的辅料,应该尤为注意。
以某软胶囊仿制药开发为例,药物开发中QTTP要素分析如下:
表1 QTTP要素分析
| QTTP要素 | 目标 | 依据 |
| 剂型 | 软胶囊 | 药学等效性要求:相同剂型;XX药品在水中溶解度低,在油相中溶解度高。且单剂量给药小,制备成固体制剂难分散均匀 |
| 给药途径 | 口服 | 药学等效性要求:相同的给药途径;XX胃肠吸收,迅速起效;加上单剂量小等原因,选择口服给药比较合适。 |
| 剂量 | 1mg | 药学等效性要求:相同剂量 |
| 药代动力学 | 在进食情况下,PK参数(AUC0-t,Tmax,Cmax)90%置信区间应该落在生物等效性限度之内 | 生物等效性要求 |
| 稳定性 | 室温下储存36个月 | 等于或优于参照药品储存期 |
| 药品质量属性 | 物理性质 | 药学等效性要求:符合相同药典标准或其他适用的(质量)标准(鉴别、含量、纯度及质量) |
| 鉴别 | ||
| 含量 | ||
| 降解物 | ||
| 残留溶剂 | ||
| 药物释放(溶出) | ||
| 微生物限度 | ||
| 水分 | ||
| 包装系统 | 适宜包装系统以实现既定的贮存期并确保运输期间胶囊的完整性 | 容器材质:高密度聚乙烯瓶装 |
| 给药途径与说明书一致 | 进食后服药,饭前服药影响未知,原研厂家只做饭后服用药物临床 | 参照说明书已经提供给的信息 |
| 可替代的给药方法 | 无 | 参比药品在说明书中没有列出 |
依据QTTP要素分析找出影响QTTP的产品关键质量属性CQAs,如含量,含量均一度,溶出,有关物质等。以此为考察目标,接下来对处方筛选及工艺开发进行风险评估。
二、 处方开发中的风险评估
(1)、原辅料初始风险评估
结合实际情况,原辅料准备涉及的风险评估因素如下:
第一、原辅料本身的理化性质,除了一般特性外,这里应该了解API化合物的结构特征,是否有些官能团对酸碱,氧或光照不稳定,或者能与辅料发生化学反应,还可能与辅料中某些残留物发生化学反应。这些因素在原辅料准备过程中应该注意的。涉及到不同厂家来源的辅料,即使满足的质量标准一样,但由于制备工艺不一样,一些物理性质,如比表面积,微观表征,这些特性可能影响药物的释放与工艺顺利度。
第二、有些涉及到关联审评的辅料,在此应该列入初始风险评估,主要考虑到厂家有无关联审评意向及厂家供货稳定性。
(2)、处方筛选中的QbD概括
初始风险评估确定CQAs及因变量→通过DOE试验或者单因素试验考察→结果分析,确定范围及最佳处方参数→风险评估更新(通过试验降低该项风险的说明)
三、工艺筛选中的QbD概括
工艺中初始风险评估包括两大项:输入物料属性及工艺参数(包括设备型号评估),确定影响产品质量的CQAs→DOE试验或单因素试验→结果分析,确定范围及最佳处方参数→风险评估更新(通过试验降低该项风险的说明)。这里需要注意的是,初始风险评估并不一定完全涵盖各过程的CQAs,当试验过程中出现影响产品CQAs的关键参数时,因及时列入风险评估范畴,并展开系统试验。
在此以干法制粒工艺为例
干法制粒步骤影响片剂含量均匀度和溶出度的风险被确定为高风险,整粒步骤影响片剂的含量均一度的风险也被确定为高风险。薄片密度、颗粒粒度分布、和颗粒流动性被确定为干法制粒和整粒步骤得到的中间体CQAs。工艺风险评估前都应该对输入物料进行风险评估。
在干法制粒工序中,不同干法制粒机型号及厂家有区别。主要分为横向螺杆下料及纵向螺杆下料。在此仅对横向螺杆下料干法制粒工艺风险评估进行说明。

图a 纵向螺杆下料(图片来源:百度图库)
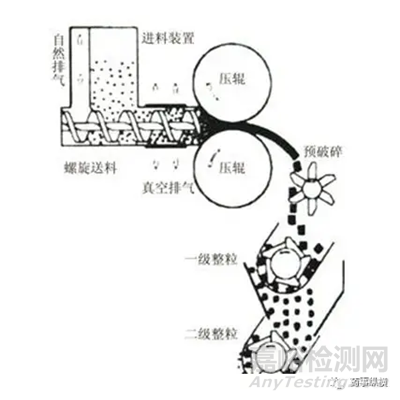
图b 横向螺杆下料(图片来源:百度图库)
(1)首先对干法制粒输入物料及工序进行风险评估,确定高风险影响因素:
表2 干法制粒和整粒工艺变量初始风险评估
| 工艺步骤:干法制粒和整粒 | |||
| 输出物料CQAs:薄片密度、颗粒粒度分布、颗粒流动性、含量均一度 | |||
| 变量 | 输出物料CQAs | 风险评估 | 合理性说明和初始策略 |
| 输入物料属性 | |||
| 粉体学性质(如流动性,可压性,堆密度) | 薄片密度 | 中 | 物料可压性决定了是否可压成薄片,从而影响整粒及颗粒粒度分布,但薄片密度可控范围广,对成品质量影响小,风险中 |
| 颗粒粒度分布 | 低 | 颗粒力度分布主要在于整粒工序,混粉均一度对其影响小,风险低 | |
| 含量均一度 | 高 | 流动性不好,可能会影响含量均一度 | |
| 颗粒流动性 | 低 | 颗粒流动性主要看制备成粒子粒度分布,混粉均一度对其影响小,风险低 | |
| 混粉含量均匀度 | 薄片密度 | 中 | 当原料比例大时,含量不均一可能影响薄片密度,风险中 |
| 颗粒粒度分布 | 低 | 颗粒力度分布主要在于整粒工序,混粉均一度对其影响小,风险低 | |
| 含量均一度 | 高 | 物料含量不均,可能导致干法制备成的粒子含量不均,应该在预混工序中考察,风险高 | |
| 颗粒流动性 | 低 | 颗粒流动性主要看制备成粒子粒度分布,混粉均一度对其影响小,风险低 | |
| 工艺参数 | |||
| 压轮面设计 | 薄片密度 | 低 | 压轮面设计上增加摩擦力,增加进料。被视为一个固定因素。风险低。但是不同压轮面对粘压轮效果影响不同,如原料较粘的物料用平面轮比网纹合适 |
| 颗粒粒度分布 | 低 | 颗粒力度分布于整粒相关,风险低 | |
| 含量均一度 | 低 | 含量均匀度于输入物料均匀度及流动性相关,压轮面对其影响不大。风险低 | |
| 颗粒流动性 | 低 | 颗粒流动性与整粒后力度分布相关,压轮面对其影响小,风险低 | |
| 压轮压力 | 薄片密度 | 高 | 薄片密度与压轮压直接相关。风险高 |
| 颗粒粒度分布 | 高 | 薄片密度与压轮压相关,进而影响整粒后颗粒均匀度。风险高 | |
| 含量均一度 | 高 | 同上说明 | |
| 颗粒流动性 | 高 | 同上说明 | |
| 压轮间隙 | 薄片密度 | 高 | 与薄片密度成反比,风险高 |
| 颗粒粒度分布 | 高 | 凡是影响薄片密度,都对其影响 | |
| 含量均一度 | 高 | 凡是影响薄片密度,都对其影响 | |
| 颗粒流动性 | 高 | 凡是影响薄片密度,都对其影响 | |
| 整粒速度 | 薄片密度 | NA | NA |
| 颗粒粒度分布 | 高 | 整粒速度快慢,导致整粒桨对薄片剪切力不一样,出来的粒子粗细不一样,影响粒度风险高 | |
| 颗粒均一度 | 高 | 影响粒度分布,进而影响混合均一度 | |
| 颗粒流动性 | 高 | 影响粒度分布,进而影响流动性 | |
| 整粒筛网孔径 | 薄片密度 | NA | NA |
| 颗粒粒度分布 | 高 | 筛网孔径粗细,影响颗粒大小,对粒度分布影响风险高 | |
| 含量均一度 | 高 | 影响颗粒粒度分布,从而对其影响 | |
| 颗粒流动性 | 高 | 影响颗粒粒度分布,从而对其影响 | |
(2)对压轮压力、压轮间隙、整粒速度及筛网孔径等影响成品CQAs的高风险因素进行实验考察:
从初始风险评估中提取高度风险,进行重点实验设计评估,确认合适的参数范围,所用部分析因DOE设计。
表3 研究干法制粒和整粒工艺变量的24-1部分析因DOE
|
因子 |
工艺变量 |
水平 |
||
|
-1 |
0 |
+1 |
||
|
A |
压轮压力 |
|||
|
B |
压轮间隙 |
|||
|
C |
整粒速度 |
|||
|
D |
筛网孔径 |
|||
|
因变量 |
考察指标 |
目标 |
可接受范围 |
|
|
Y1 |
薄片密度 |
适中 |
||
|
Y2 |
粒度分布 |
均一 |
不能细分含量太多,有粘冲风险 |
|
|
Y3 |
颗粒含量均一度 |
RSD最小化 |
||
|
Y4 |
颗粒流动性 |
休止角最小 |
休止角<40° |
|
|
Y5 |
中间体可压性 |
硬度最大化 |
||
|
Y6 |
与参比溶出相似度(F2) |
与参比最相似 |
最终目标是溶出曲线与参比制剂最相似 |
|
备注:此表仅提供实验设计思路,具体参数不列出。
运用minitab软件进行分析,实验结果显示合理可控制的工艺参数范围
(3)风险评估更新
表4 干法制粒和整粒工艺变量风险评估更新
|
工艺步骤:干法制粒和整粒 |
|||
|
输出物料CQA:薄片密度,颗粒粒度分布,含量均匀度和颗粒流动性 |
|||
|
工艺变量 |
输出物料CQA |
风险评估 |
风险降低合理性说明 |
|
压轮压力 |
薄片密度 |
低 |
确定了压轮压力可接受范围,使工艺过程可控及溶出与参比最相似且可控,风险降低 |
|
颗粒粒度分布 |
低 |
||
|
含量匀一度 |
低 |
||
|
颗粒流动性 |
低 |
||
|
压轮隙 |
薄片密度 |
低 |
确定压轮间隙范围,到达CQAs可接受标准,使工艺过程可控及溶出与参比最相似且可控,风险降低 |
|
颗粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
颗粒流动性 |
低 |
||
|
整粒速度 |
薄片密度 |
低 |
确定整粒速度范围,使其在范围内对CQAs无明显影响,使工艺过程可控及溶出与参比最相似且可控。因此,风险降至低 |
|
颗粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
颗粒流动性 |
低 |
||
|
整粒筛目孔径 |
薄片密度 |
低 |
整粒筛目孔径确定,使得压轮压力和压轮间隙可接受范围更强,使CQAs达预定标准,使工艺过程可控及溶出与参比最相似且可控,风险降至低 |
|
颗粒粒度分布 |
低 |
||
|
含量均一度 |
低 |
||
|
颗粒流动性 |
低 |
||
风险评估策略:初始风险评估提出高风险因素→这些因素影响的CQAs指标→通过试验筛选得到合适范围→风险更新评估降至低级
四、工艺放大中的QbD概括
工艺放大中,应该评估哪些参数可能影响工艺放大后产品CQAs,如筛网孔径,过筛转速,粉碎整粒机型号,混合料斗装量体积,转速/数等。能否等比放大,或者按照一定运算公式放大。
五、总结
QbB就是在研发阶段,试验开始前,充分评估各参数对产品CQAs的影响,然后再通过试验确认合理的范围以降低其风险的过程。
【参考文献】
《QBD与药品研发概念与实例》一书

来源:Internet


